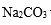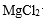- 化学反应原理
- 共2396题
下述实验不能达到预期实验目的的是
正确答案
解析
略
知识点
下列有关实验操作、现象和解释或结论都正确的是
正确答案
解析
略
知识点
欲检验CO2气体中是否含有SO2、HCl,进行如下实验:
①将气体通入酸化的AgNO3溶液中,产生白色沉淀a;
②滤去沉淀a,向滤液中加入Ba(NO3)2溶液,产生白色沉淀b。
下列说法正确的是
正确答案
解析
略
知识点
实验:① 向盛有1 mL 0.1 mol/L MgCl2溶液试管中加1 mL 0.2 mol/L NaOH溶液,得到浊液a,过滤得到滤液b和白色沉淀c。
② 向沉淀c中滴加0.1mol/L FeCl3溶液,沉淀变为红褐色。
下列分析不正确的是
正确答案
解析
略
知识点
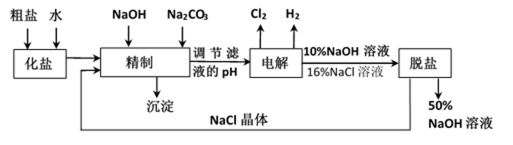
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图完成下列问题:
(1)在电解过程中,阴极上生成气体的电子式为 。
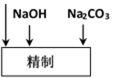
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 。
(3)精制过程要除去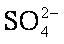
a. Ba(OH)2
b.Ba(NO3)2
c.BaCl2
(4)在实际生产中也可以用BaCO3除去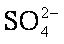
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、 (填操作名称)而制得50%的NaOH溶液。
正确答案
见解析。
解析
(1)H:H
(2)Mg2++2OH-=Mg(OH)2↓
(3)ac
(4)由于BaSO4比BaCO3的溶解度小,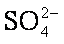

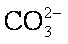
平衡正向移动,生成更难溶的BaSO4沉淀。
(5)结晶、过滤
知识点
已知:
对于含Fe2(SO4) 3、FeSO4和CuSO4各0.5mol的混合溶液1L,根据上表数据判断,下列说法错误的是
正确答案
解析
略。
知识点
根据下列实验现象,所得结论不正确的是
正确答案
解析
略
知识点
下述实验能达到预期目的的是
正确答案
解析
略
知识点
下表中的实验操作能达到实验目的或能得出相应结论的是
正确答案
解析
略
知识点
下列有关现象或反应的原理解释正确的是
正确答案
解析
略。
知识点
下列实验方案不能达到实验目的的是
正确答案
解析
略
知识点
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
正确答案
解析
略。
知识点
实验:① 0.1 mol·L-1 MgCl2溶液和0.2 mol·L-1NaOH溶液等体积混合得到浊液a,取少量浊液a过滤得到滤液b和白色沉淀c;
② 向浊液a中滴加0.1 mol·L-1FeCl3溶液,出现红褐色沉淀。
下列分析不正确的是
正确答案
解析
略
知识点
下列实验操作、现象与结论对应关系正确的是( )
正确答案
解析
略
知识点
在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用。请回答下列问题:
Ⅰ:(1)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)
① 已知该反应的平衡常数K195℃ < K165℃,则该反应的△H_______0(填“>”“=”或“<”)。
② 一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)n(NH3)/ n(CO2)=x,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大的原因是________;B点处,NH3的体积分数为_______%(保留小数点后一位)。
③取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,CO(NH2)2(l)的质量_____(填“增加”、“减小”或“不变”)。
Ⅱ:(1)某温度下,纯水中c(H+) = 2.0×10-7mol/L,该温度下,0.9mol/L NaOH
溶液与0.1 mol/L HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=_________。
(2)向100 mL 0.10 mol/L CH3COOH的溶液中加入0.010 mol CH3COONa固体,溶液pH增大,主要原因是(请用学过的平衡理论解释)____________________;
已知该混合溶液中c(Na+)<c(CH3COO-),则c(CH3COOH)______c(CH3COO-)(填“>”、“<”或“=”)
Ⅲ:(1)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,
溶液的S2—浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。
(2)向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,
振荡后,ZnS沉淀最终会转化为 (填化学式)沉淀。
正确答案
见解析。
解析
Ⅰ: (1)①<
②增大氨气浓度,平衡正向移动,CO2转化率增大;85.7
③不变
Ⅱ:(1)13
(2)醋酸溶液中存在电离平衡:CH3COOH
Ⅲ:(1)FeS
(2)PbS
知识点
扫码查看完整答案与解析