- 极性分子和非极性分子
- 共11题
374℃、22.1Mpa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH-,由此可知超临界水
正确答案
解析
略
知识点
Ⅰ.第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类 1000年的能源需要。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子。根据上述信息,完成下面两题:
(1)下列关于天然气水合物中两种分子描述正确的是
A.两种都是极性分子 B.两种都是非极性分子
C.H2O是极性分子,CH4是非极性分子 D.其中氧原子和碳原子的杂化方式分别为sp2和sp3
E.其中氧原子和碳原子的杂化方式均为sp3
(2)晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为
II、A、B、C、D是短周期元素,它们的离子具有相同的电子层结构,且半径依次减小。A与D的化合物X既能与盐酸反应,又能与NaOH溶液反应;B、C组成典型的离子化合物Y,其晶体结构类似于NaCl晶体;A与C以原子个数之比1︰1组成化合物Z。
(3)写出Z的电子式
(4)C元素焰色反应的颜色为 试从原子结构的角度解释其原因
(5)B、C、D可组成离子化合物CmDBn,其晶体结构单元如右图所示。阳离子Cx+(○表示)位于正方体的棱的中点和正方体内部(内部有9个○,1个位于体心,另8个位于大正方体被等分为8个小正方体后的体心);阴离子DBnmx-(●表示)位于该正方体的顶点和面心。则:x= 、m= 、n= 。已知该晶体的密度为a g/cm3 ,则该晶体
正确答案
中阳离子间的最近距离为
(1)CE
(2)CH4·8H2O或6CH4·48H2O
(3)
(4)黄色;在加热的条件下钠原子的核外电子吸收能量,电子从基态跃迁到激发态,电子处于激发态不稳定又重新跃迁到基态,在此过程中以光波的形式释放能量。
(5)1;3;6;
解析
略
知识点
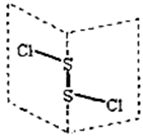
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右下图所示。常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体。下列说法错误的是()
正确答案
解析
略
知识点
PH3一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断错误的是
正确答案
解析
本题考查化学键、分子构型。意在考查考生分子结构的知识。PH3同NH3构型相同,因中心原子上有一对孤电子对,均为三角锥形,属于极性分子,故A、B项正确;PH3的沸点NH3,是因为NH3分子间存在氢键,C项错误;PH3的稳定性低于NH3,是因为N-H键键能高,D项正确。
知识点
(1)下列分子中,属于非极性的是_______。
A. SO2
B. BeCl2
C. BBr3
D. COCl2
(2)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为_______;
2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______;
3)SO42-的立体构型是_______,其中S原子的杂化轨道类型是_______;
4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为_______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是_______;
5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为_______。
正确答案
(1)BC
(2)1)Cu+2H2SO4(浓)
解析
(1)根据价层电子对互斥理论(VSEPR)可得四种分子的结构如下:
(2)本题各小题内容考查点相互的联系不大,仍属于“拼盘”式题。3)硫酸根中心原子的价层电子对为:孤对电子数6-2×4+2=0,成键电子对数4,所以为正四面体结构,中心原子为sp3杂化;4)Au电子排布或类比Cu,只是电子层多两层,由于是面心立方,晶胞内N(Cu)=6×

知识点
下列分子中,属于含有极性键的非极性分子的是
正确答案
解析
略
知识点
如图是某无机化合物的二聚分子,该分子中A、B两种元素都是第三周期的元素,分子中所有原子的最外层电子都达到8个电子的稳定结构。下列说法不正确的是
正确答案
解析
略
知识点
6.下列有关化学键的叙述,不正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.下列叙述不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.下列叙述中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析