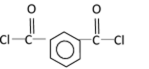
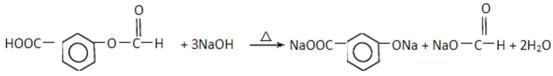- 热化学方程式
- 共127题
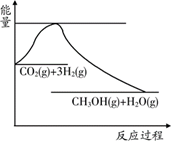
为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,科学家正在研究如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g) + 3H2(g)
(1)上图表示该反应过程中能量变化,则该反应为 反应(填“吸热”或“放热”),判断依据是 ;
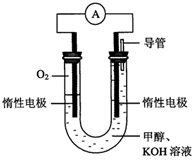
(2)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。
①该电池正极的电极反应式为: ;
② 工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为: ;
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO(g) + O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: ;
(4)为了消除污染,在一定条件下,向含有甲醇的废水中加入一定量的稀硝酸,会有N2等物质生成。若参加反应的氧化剂和还原剂的物质的量之比为6∶5,写出该反应的化学方程式 ;在此反应过程中若消耗32 g 甲醇,将转移
mol 电子。
正确答案
见解析。
解析
(1)放热; 生成物总能量低于反应物总能量 ;
(2) ① O2 + 2H2O + 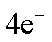
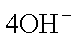
② 2CH3OH + 3O2 + 4KOH = 2K2CO3 + 6H2O ;
(3)CH3OH(l) + O2(g) = CO(g) + 2H2O(l) ΔH =﹣442.8 kJ∕mol ;
(4)5CH3OH + 6HNO3 = 3N2 ↑ + 5CO2 ↑ + 13H2O ; 6 。
知识点
聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等
领域具有广泛应用。下图是利用乙酰丙酸(
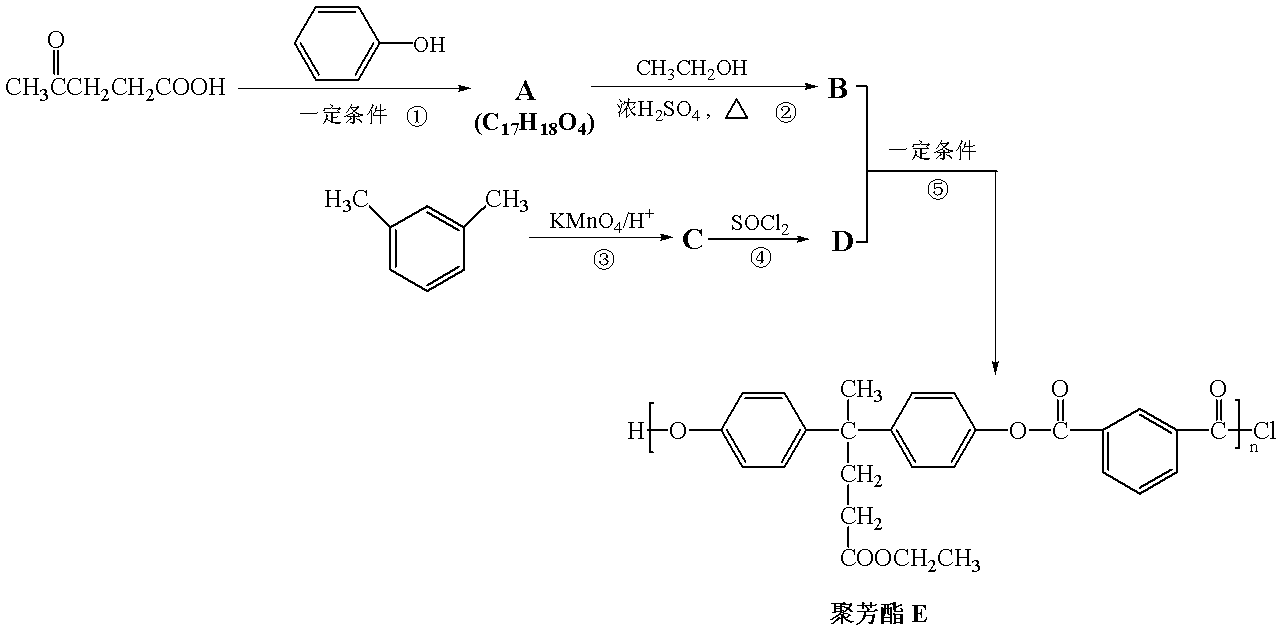
②
(R、R’表示烃基)
(1)乙酰丙酸中含有的官能团是羰基和 (填官能团名称)。
(2)下列关于有机物A的说法正确的是 (填字母序号)。
a.能发生加聚反应
b.能与浓溴水反应
c.能发生消去反应
d.能与H2发生加成反应
(3)A→B的化学方程式为 。
(4)D的结构简式为 。
(5)C的分子式为 ,符合下列条件的C的同分异构体有 种。
①能发生银镜反应 ②能与NaHCO3溶液反应
③分子中有苯环,无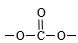
在上述同分异构体中,有一类有机物分子中苯环上只有2个取代基,写出其中任一
种与足量NaOH溶液共热反应的化学方程式: 。
正确答案
见解析。
解析
(1)羧基
(2)bd
(3)
(4)
(5) C8H6O4 13
知识点
大气中的部分碘源于O3对海水中Ⅰ-的氧化。将O3持续通入NaⅠ溶液中进行模拟研究。
(1)O3将Ⅰ-氧化成Ⅰ2的过程由3步反应组成:
①Ⅰ-(aq)+ O3(g)=ⅠO-(aq)+O2(g)△H1
②ⅠO-(aq)+H+(aq) 
总反应的化学方程式为______,其反应△H=______
(2)在溶液中存在化学平衡:
(3) 为探究Fe2+对氧化Ⅰ-反应的影响(反应体如图13),某研究小组测定两组实验中Ⅰ3-浓度和体系pH,结果见图14和下表。
① Ⅰ组实验中,导致反应后pH升高的原因是_______.
② 图13中的A为_____由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是_______.
③第2组实验进行18s后,Ⅰ3-下降。导致下降的直接原因有双选______.
(4)据图14,计算3-13s内第2组实验中生成l3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
正确答案
(1)
(2)
(3)①H+被消耗,其浓度降低;②


(4)
解析
本题考查了盖斯定律、化学平衡常数,化学平衡的移动以及化学反应速率的计算等知识。(1)根据题给信息,总反应为O3氧化I-生成I2,将所给的三个反应:①+②+③可得



③c(Fe3+)增加,
v(I3-)=
知识点
在构成宇宙万物的一百多种元素中,金属约占了80%,它们在现代工业和新材料、新技术研究中具有至关重要的意义。现有a、b、c、d四种金属元素,a是人体内含量最多的金属元素,b是地壳中含量最多的金属元素,c是海水中含量最多的金属元素,d是人类冶炼最多的金属元素。
(1)元素a在元素周期表中的位置为 ;a原子的核外能量不同的电子有 种。
(2)下列可以证明b、c金属性强弱的是 。
A,最高价氧化物对应水化物的溶解性:b
B,单质与水反应的剧烈程度:b
C,相同条件下,氯化物水溶液的pH值:b
D,c可以从b的氯化物水溶液中置换出b
(3)人类冶炼d的时候一般得到的是d的合金,潮湿环境中其表面会产生一层水膜,从而发生腐蚀。下列关于该腐蚀的说法正确的是 。
A,腐蚀过程中,一定会有气体放出
B,腐蚀过程中,水膜的碱性会增强
C,在酸性条件下,负极的电极反应式为:
D,与电源的负极相连,可以防止发生这种腐蚀
(4)d单质在高温下会与水蒸气反应生成一种黑色固体和一种易燃性气体,且每生成1 mol该易燃气体放出37.68 kJ热量,请写出此反应的热化学方程式: 。
正确答案
(1) 第四周期ⅡA族 ) 6种
(2) BC
(3) BD
(4)3Fe (s) + 4H2O (g) → Fe3O4 (s) +4H2 (g) +150.72kJ
解析
略
知识点
合成氨尿素工业生产过程中涉及到的物质转化过程如下图所示。
(1)天然气在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为 。
(2)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来。运用化学平衡的
知识分析这样做的是否有利于氨的合成
(3)右图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数。
①若分别用υA(NH3)和υB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则υA(NH3) υB(NH3)(填“>”、“<”或“=”)。
②在相同温度、当压强由p1变为p3时,合成氨
反应的化学平衡常数 。(填“变大”、“变小”或“不变”)。
③在250℃、1.0×104 kPa下,H2的转化率为 %(计算结果保留小数点后
1位)。
(4)NH3(g) 与CO2(g) 经过两步反应生成尿素,
NH3(g) 与CO2(g) 反应生成尿素的热化学方程式为 。
(5)运输氨时,不能使用铜及其合金制造的管道阀门。因为,在潮湿的环境中,金属
铜在有NH3存在时能被空气中的O2氧化,生成Cu(NH3)42+,该反应的离子方程
式为 。
正确答案
见解析。
解析
(1)
(2)移走氨气,减小生成物浓度,平衡右移,有利于氨生成
(3)① <
② 不变
③ 66.7%
(4)2NH3(g) + CO2(g) === CO(NH2)2(s) + H2O(l) △H = -134 kJ/mol
(5)2Cu + 8NH3 + O2 + 2H2O === 2Cu(NH3)42+ + 4OH-
知识点
磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物有着广泛的应用。
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成
1mol产物的数据)。
请回答问题:
①PCl5分解成PCl3和Cl2的热化学方程式是 。
②P和Cl2分两步反应生成1 mol PCl5的△H3= 。新 课 标 第 一 网
(2)PCl5分解成PCl3和Cl2的反应是可逆反应。T℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过250 s达到平衡。反应过程中测定的部分数据见下表:
①反应在50~150s 内的平均速率v(PCl3)= 。
②试计算该温度下反应的平衡常数(写出计算过程,保留2位有效数字)
(3)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如右图所示。
①为获得较纯的Na2HPO4,pH应控制在 ;pH=6时,溶液中主要含磷物种浓度大小关系为:
。
②Na2HPO4溶液呈碱性,加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从离子平衡角度分析) 。
正确答案
(1)①PCl5(g)=PCl3(g)+Cl2(g) △H=+93kJ/mol(2分,方程式1分,△H的表示1分,化学式、状态错误0分;+、焓变数值、单位错漏合扣1分;计量数用分数表示与焓变相匹配也给分)
②-399 kJ/mol(2分,单位错漏扣1分)
(2)①1.5×10-4mol/(L·s) 或0.00015 mol/(L·s)(2分,单位错漏扣1分)
② PCl5(g) = PCl3(g)+Cl2(g)
起始浓度(mol/L) 
转化浓度(mol/L) 0.10 
平衡浓度(mol/L) 0.40 0.10 0.10 (1分)
K= 

或0.025mol/L
(3分,其中列式、代入数值各1分;结果1分,结果、单位、有效数字有错误合扣1分,代入数值不带单位不扣分,K值不带单位不扣分)
(3)①9~10.5(2分,介于此区间或区间内的某一点)
c(H2PO4-)>c(HPO42-) (2分)
②Na2HPO4溶液中存在电离平衡,HPO42-
解析
略
知识点
根据碘与氢气反应的热化学方程式,下列判断正确的是
① I2(g)+ H2(g) 
② I2(s)+ H2(g) 
正确答案
解析
略
知识点
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(l) ΔH3 = –44.0 kJ·mol– 1写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__________。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g)
① 一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为__________。(填“<”、“>”“=”)
② 100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,反应达平衡的标志是:__________。
A. 容器内气体密度恒定
B. 单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
C. 容器的压强恒定
D. 3v正(CH4)= v逆(H2)
如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K =__________。
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为__________。用该原电池做电源,常温下,用惰性电极电解200 mL饱和食盐水(足量),消耗的标准状况下的CO 224 mL,则溶液的pH =__________。(不考虑溶液体积的变化)
(4)氢氧燃料电池的三大优点是:__________、__________、能连续工作。
正确答案
(1)CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l)ΔH = –442。8 kJ·mol– 1
(2)① <; KC> KB >KA;②CD 2.25×10– 4mol2·mol– 2
(3)CO + 4OH– → 
(4)污染少、能量利用率高
解析
略。
知识点
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)推断B在元素周期表中的位置 ,写出E2D的电子式 。
(2)写出A与D形成的10电子阳离子的化学式 。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是 。
(4)常温下,1molA的单质在D的单质中完全燃烧生成液态水,放出286kJ的热量,写出该反应的热化学方程式 。
正确答案
见解析。
解析
(1) 第二周期 ⅣA族
(2) H3O+
(3) S2->Cl->Na+
(4) H2(g) + 1/2O2(g) === H2O(l) △H=-286kJ·mol-1
知识点
I: 已知在常温常压下:
① 2CH3OH(l)十3O2(g) 2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1
② H2O(l) H2O(g) △H=+ 44.0 kJ.mo—1
写出表示甲醇燃烧热的热化学方程式 。
II:磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图:
(1)在Na3PO4溶液中,c(Na+)/c(PO43-) 3(填“>”“=”“<”),向Na3PO4溶液中滴入稀盐酸后 ,pH从10降低到5的过程中发生的主要反应的离子方程式为 。
(2)从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是 。(填选项字母)
a、 C(Na+)> C(H2PO4 -)> C(H+)> C(HPO4 2-)> C(H3PO4 )
b、 C(Na+)> C(H2PO4 -)> C(OH-)> C( H3PO4)> C(HPO4 2- )
c、 C(H+)+ C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-)+C(H3PO4 )
d、 C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4 )
(3)假设25℃条件下测得0.1 mol·L–1的Na3PO4溶液的pH=12 ,近似计算出Na3PO4的第一步水解的水解常数Kh (写出计算过程,忽略Na3PO4的第二、第三步水解,结果保留两位有效数字)。
III,化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染。电化学降解NO3-的原理如下图所示。
电源正极为 (填A或B),阴极反应式为 。
正确答案
见解析
解析
I:CH3OH(g)+3/2 O2(g)= CO2(g)+2H2O(l) △H=-725.8kJ/mol (2分)
II:(1)> HPO4 2- + H+ === H2PO4 - (每空2分,共4分)
(2)ad(2分)
(3)PO43- + H2O 
起始浓度(mol·L–1): 0.1 0 0
变化浓度(mol·L–1): 0.01 0.01 0.01
平衡浓度(mol·L–1): 0.09 0.01 0.01 (1分)
Kh === C (HPO4 2-)× C(OH-)/ C( PO43- )=== 0.01 × 0.01 / 0.09 === 1.1 × 10 -3 mol·L–1
(2分,共4分)
II: A
2NO3-+10e-+12H+=6H2O +N2↑ (每空2分,共4分)
知识点
扫码查看完整答案与解析