- 真题试卷
- 模拟试卷
- 预测试卷
7.分子式为C9H12O,苯环上有两个取代基且含羟基的化合物,其可能的结构有
正确答案
解析
苯环上只有两个取代基,其中一个是羟基,取代基可能有羟基、正丙基,羟基、异丙基,甲基、-CH2-CH2OH,甲基、-CH2OHCH3,乙基、-CH2OH共五种,各有邻、间、对三种同分异构体,共15种.故选C.
考查方向
解题思路
先根据取代基可能有羟基、正丙基,羟基、异丙基,甲基、-CH2-CH2OH,甲基、-CH2OHCH3,乙基、-CH2OH共五种组合,然后根据两个取代基有邻、间、对三种同分异构体,据此解题.
易错点
同分异构体的书写,注意支链的确定
知识点
8.下列操作或仪器的选用正确的是
正确答案
解析
A.在容量瓶内溶解浓硫酸,放出大量的热,会导致溶液体积偏大,配制溶液浓度偏大,甚至导致容量瓶受热不均发生破裂,故A错误;B.食盐水呈中性,铁在中性溶液中可发生吸氧腐蚀,故B正确;C.直接加热氯化铵固体,分解生成氨气和氯化氢,在温度稍低时又生成氯化铵,不能得到氨气,应用氯化铵和氢氧化钙固体加热反应制备氨气,故C错误;D.乙烯被酸性高锰酸钾溶液氧化,故D错误.
考查方向
解题思路
A.不能在容量瓶中稀释溶液;B.铁在中性溶液中可发生吸氧腐蚀;C.应用氯化铵和氢氧化钙固体加热反应制备氨气;D.乙烯被酸性高锰酸钾溶液氧化.
易错点
气体的制取、电化学腐蚀、溶液的配制、除杂
知识点
10.下列说法中,不正确的是( )
①同一元素的不同核素互称为同位素
②化学键可以使离子相结合,也可以使原子相结合
③金属腐蚀的实质是金属原子失去电子被还原的过程
④Ksp不仅与难溶电解质的性质和温度有关,而且还与溶液中的离子浓度有关
⑤铅蓄电池在放电过程中,负极质量减少,正极质量增加
⑥Al和Fe在一定条件下都能与某些氧化物反应
⑦干冰和氨都属于弱电解质
⑧汽油和花生油的主要成份都是油脂
正确答案
解析
:①质子数相同中子数不同的原子互为同位素,所以同一元素的不同核素互称为同位素,故正①确;②化学键含有离子键、共价键、金属键等,离子化合物是阴、阳离子通过离子键形成,原子间可以通过共价键形成物质,如原子晶体、分子晶体,故②正确;③金属原子失去电子被氧化,不是被还原,故③错误;④Ksp与难溶电解质的性质和温度有关,与溶液中的离子浓度无关,故④错误;⑤铅蓄电池在放电过程中,负极电极反应式Pb+SO42--2e-=PbSO4,负极质量增加,正极电极反应式为PbO2+4H++SO42-+2e-=PbSO4+2H2O,正极质量增加,故⑤错误.⑥Al和Fe在一定条件下都能与某些氧化物反应,如铝热反应、Fe与水蒸气反应生成四氧化三铁与氢气,故⑥正确;⑦干冰和氨属于根据化合物,溶液水自身不能电离出离子,而是与水反应生成的碳酸、一水合氨电离出的离子,使溶液导电,是碳酸、一水合氨电解质,干冰与氨是非电解质,故⑦错误;⑧汽油属于烃,花生油是高级脂肪酸与甘油形成的酯,属于油脂,故⑧错误.故③④⑤⑦⑧.
考查方向
解题思路
】①质子数相同中子数不同的原子互为同位素,即同一元素的不同核素互称为同位素.②化学键含有离子键、共价键、金属键等,离子化合物是阴、阳离子通过离子键形成,原子间可以通过共价键形成物质,如原子晶体、分子晶体.③金属原子失去电子被氧化.④Ksp与难溶电解质的性质和温度有关,与溶液中的离子浓度无关.⑤铅蓄电池在放电过程中,负极电极反应式Pb+SO42--2e-=PbSO4,正极电极反应式为PbO2+4H++SO42-+2e-=PbSO4+2H2O.⑥Al和Fe在一定条件下都能与某些氧化物反应,如铝热反应、Fe与水蒸气反应.⑦干冰和氨属于根据化合物,溶液水自身不能电离出离子,而是与水反应生成的碳酸、一水合氨电离出的离子,使溶液导电.⑧汽油属于烃,花生油是高级脂肪酸与甘油形成的酯,属于油脂.
易错点
同位素、化学键、金属腐蚀、溶度积常数、原电池、电解质与非电解质、油脂与烃、元素化合物性质
知识点
1、化学与人类生活密切相关,下列与化学有关的说法不正确的是
正确答案
解析
A.开发和推广使用新能源,减少化石燃料的使用,可以减少二氧化碳等温室气体的排放,是实现低碳生活的途径之一,故A正确;B.化学药品着火,像钠着火就不能用水或泡沫灭火器灭火,故B错误;C.食品添加剂用多了,会造成对身体的伤害,故C正确;
D.导致“雾霾天气“的原因有多种,化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的原因之一,故D正确,
考查方向
解题思路
A.开发和推广使用新能源,减少化石燃料的使用,可以减少二氧化碳等温室气体的排放;B.化学药品着火,像钠着火就不能用水或泡沫灭火器灭火;C.食品添加剂用多了,会造成对身体的伤害;D.导致“雾霾天气“的原因有多种,化石燃料燃烧和工业废气中的氮氧化物均是导致“雾霾天气”的原因之一.
易错点
化学与生产生活相关的知识
知识点
2、用NA表示阿伏加德罗常数,下列叙述中不正确的是( )
①32 g S8单质(S8分子结构如右图)中含有的S—S键个数为NA
②电解精炼铜时转移了NA个电子,阳极溶解32 g铜
③7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA
④2 mol SO2和1 mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2 NA
⑤2.9 g熟石膏(2CaSO4·H2O)含有的结晶水分子数为0.02 NA (2CaSO4·H2O式量为290)
⑥含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
正确答案
解析
:①一个S8分子(其“皇冠”结构如图)中含有的S-S键个数为8个,32gS8单质物质的量=32g/8×32g/mol=0.125mol,含有的S-S键个数为NA,故正确;②电解精炼铜时转移了NA个电子,电子的物质的量为1mol,阳极的粗铜中含有铁锌等杂质,活泼性均大于铜的,所以电解时先失去电子,所以转移0.5mol电子,阳极溶解的铜的物质的量小于0.5,质量小于32g,故错误;③1mol过氧化钠中含有1mol阴离子,7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA,故错误;④可逆反应不能进行彻底,2molSO2和1molO2,混合气体在催化剂作用下反应容器中物质分子数大于2NA,故正确;⑤2.9g 2CaSO4•H2O物质的量=0.01mol,含有的结晶水分子数为0.01NA,故错误;⑥随着反应进行,硫酸浓度降低,不再与铜反应,所以生成SO2的分子数小于0.1NA.故错误;故选:C.
考查方向
解题思路
】①一个S8分子(其“皇冠”结构如图)中含有的S-S键个数为8个;②根据粗铜中含有摩尔质量比铜小且活泼性比铜大的杂质分析;③硫化钠和过氧化钠的摩尔质量相等,1mol过氧化钠中含有1mol阴离子;④二氧化硫和氧气反应是可逆反应不能进行彻底;⑤质量换算物质的量结合化学式计算;⑥只有浓硫酸与铜反应,稀硫酸与铜不反应.
易错点
阿伏加德罗常数的有关计算和判断
知识点
3、常温下,有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的盐酸;③pH=11的氨水;④pH=11的NaOH溶液。下列说法正确的是( )
正确答案
解析
pH=3的CH3COOH溶液中c(CH3COOH)>10-3 mol/L,pH=3的盐酸中c(HCl)=10-3 mol/L,pH=11的氨水中c(NH3.H2O)>10-3 mol/L,pH=11的NaOH溶液中c(NaOH)=10-3 mol/L,A、①与②混合,由于平衡常数不变,CH3COOH、CH3COO-浓度均减半,则氢离子浓度不变,混合溶液的pH=3,c(H+)=0.001mol•L-1,故A错误;B、①和④混合后,醋酸过量,溶液中的溶质为CH3COOH和CH3COONa,故c(Na+)<c(CH3COO-)+c(CH3COOH),故B错误;C、②和③混合后,氨水过量,溶液中的溶质是NH3•H2O和NH4Cl,溶液显碱性,故有:c(H+)<c(OH-),根据电荷守恒可知:c(Cl-)<c(NH4+),故有:c(Cl-)+c(H+)<c(NH4+)+c(OH-),故C错误;D.将这四种溶液加水稀释100倍,促进醋酸和一水合氨电离,导致醋酸中氢离子浓度大于盐酸,氨水中氢氧根离子浓度大于氢氧化钠,但酸仍然是酸,碱仍然是碱,所以这四种溶液的pH大小顺序是:③>④>②>①,故D正确.
考查方向
解题思路
pH=3的CH3COOH溶液中c(CH3COOH)>10-3 mol/L,pH=3的盐酸中c(HCl)=10-3 mol/L,pH=11的氨水中c(NH3.H2O)>10-3 mol/L,pH=11的NaOH溶液中c(NaOH)=10-3 mol/L,A、①与②混合,CH3COOH浓度改变,pH变化;B、①和④混合后,醋酸过量;C、②和③混合后,氨水过量,溶液中的溶质是NH3•H2O和NH4Cl,根据电荷守恒来分析;D、根据酸、碱的相对强弱确定稀释后酸、碱的pH.
易错点
电解质的电离、酸碱混合溶液定性判断等知识点来分析解答,易错选项是B,注意二者等体积混合时,醋酸过量,溶液中的溶质为醋酸和醋酸钠,为易错点.
知识点
4.用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是( )
①加盐酸溶解 ②加烧碱溶液溶解 ③过滤
④通入过量CO2生成Al(OH)3 沉淀
⑤加入盐酸生成Al(OH)3 沉淀 ⑥加入过量烧碱溶液
正确答案
解析
镁、铝都能与酸反应,但铝可溶于强碱所以可加入烧碱溶液溶解,过滤后可到NaAlO2溶液,在反应后的溶液中加入弱酸,可通入过量CO2,生成Al(OH)3沉淀,经过滤、洗涤可得到纯净的氢氧化铝.正确顺序为②③④③,故选B.
考查方向
解题思路
铝可与NaOH溶液反应生成NaAlO2,在反应后的溶液中加入弱酸,可通入过量CO2,生成Al(OH)3沉淀,经过滤、洗涤可得到纯净的氢氧化铝.
易错点
物质的分离、提纯的实验方案的设计
知识点
5.芳香化合物M的结构简式为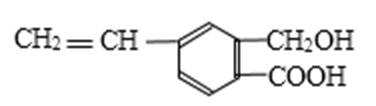
正确答案
解析
:A.由有机物结构简式可知有机物分子式为C10H10O3,故A错误;B.分子中含有羧基,可与碳酸钠发生反应生成二氧化碳气体,1mol Na2CO3最多能消耗2mol有机物M,故B错误;C.分子中含有羟基和羧基,都可与钠反应生成氢气,题中没有明确是否标准状况下,故C错误;D.有机物含有碳碳双键,可发生加成、加聚和氧化反应,含有羟基、羧基,可发生取代反应,故D正确.
考查方向
解题思路
有机物含有碳碳双键,可发生加成、加聚和氧化反应,含有羟基,可发生取代、氧化反应,含有羧基,具有酸性,可发生中和、酯化反应,以此解答该题.
易错点
有机物组成、结构以及性质的考查
知识点
6.现有X、Y、Z三种常见短周期元素,Y、Z为同周期金属元素,且X和Y的某种化合物为淡黄色固体M,Y、Z的最高价氧化物对应的水化物可以反应生成盐N和水。下列说法不正确的是
正确答案
解析
有X、Y、Z三种常见短周期元素,且X和Y的某种化合物为淡黄色固体M,则M为Na2O2,X、Y分别为Na、O中的一种,Y、Z为同周期金属元素,可推知Y为Na、X为O,且Y、Z的最高价氧化物对应的水化物可以反应生成盐N和水,则Z为Al、N为NaAlO2,
A.M为Na2O2,与水反应生成氢氧化钠与氧气,故A正确;
B.Al单质的薄片在酒精灯上加热,表面生成氧化铝薄膜,氧化铝熔点比较Al高,故加热时熔化,但不滴落,故B正确;C.Y的最高价氧化物对应的水化物为NaOH,能抑制水的电离,N为NaAlO2,在溶液中发生水解,能促进水的电离,故C错误;D.Na2O2、NaAlO2都属于离子化合物,均含有离子键,过氧化钠中过氧根中氧原子之间形成共价键,偏铝酸钠中偏铝酸根中存在共价键,故D正确,
考查方向
解题思路
有X、Y、Z三种常见短周期元素,且X和Y的某种化合物为淡黄色固体M,则M为Na2O2,X、Y分别为Na、O中的一种,Y、Z为同周期金属元素,可推知Y为Na、X为O,且Y、Z的最高价氧化物对应的水化物可以反应生成盐N和水,则Z为Al、N为NaAlO2,据此解答.
易错点
结构性质位置关系应用,推断元素是解题关键,X和Y的某种化合物为淡黄色固体是推断突破口
知识点
9、常温下,下列各组离子在指定溶液中一定能大量共存的是( )
①pH=0的溶液:Na+、C2O42﹣、MnO4﹣、SO42﹣
②pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣、S2﹣、SO32﹣
③水电离的H+浓度c(H+)=10﹣12mol·L﹣1的溶液中:Cl﹣、CO32﹣、NO3﹣、NH4+、SO32﹣
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl﹣、K+、SO42﹣
⑤使石蕊变红的溶液中:Fe2+、MnO4﹣、NO3﹣、Na+、SO42﹣
⑥中性溶液中:Fe3+、Al3+、NO3﹣、I﹣、Cl﹣、S2﹣.
正确答案
解析
:①pH=0的溶液中氢离子浓度为1mol/L,MnO4-在酸性条件下能够氧化C2O42-,在溶液中不能大量共存,故①错误;②pH=11的溶液中氢氧根离子浓度为0.001mol/L,CO32-、Na+、AlO2-、NO3-、S2-、SO32-离子之间不发生反应,都不与氢氧根离子反应,在溶液中能够大量共存,故②正确;③水电离的H+浓度c(H+)=10-12mol•L-1的溶液中存在大量氢离子或氢氧根离子,CO32-、SO32-与氢离子反应,NH4+与氢氧根离子反应,在溶液中不能大量共存,故③错误;④加入Mg能放出H2的溶液中存在大量氢离子,Mg2+、NH4+、Cl-、K+、SO42-离子之间不反应,且都不与氢离子反应,在溶液中能够大量共存,故④正确;⑤使石蕊变红的溶液中存在大量氢离子,MnO4-、NO3-在酸性条件下具有强氧化性,能够氧化Fe2+,在溶液中不能大量共存,故⑤错误;⑥Fe3+能够氧化I-、S2-,Al3+在溶液中与S2-发生双水解反应,在溶液中不能大量共存,故⑥错误;根据以上分析,在溶液中能够大量共存的为②④
考查方向
解题思路
①pH=0的溶液为酸性溶液,高锰酸根离子在酸性条件下具有强氧化性,能够氧化醋酸根离子;②pH=11的溶液中存在大量氢氧根离子,:CO32-、Na+、AlO2-、NO3-、S2-、SO32-离子之间不满足离子反应发生条件,且都不与氢氧根离子反应;③水电离的H+浓度c(H+)=10-12mol•L-1的溶液为酸性或者碱性溶液,碳酸根离子、亚硫酸根离子能够与氢离子反应,铵根离子能够与氢氧根离子反应;④加入Mg能放出H2的溶液中存在大量氢离子,Mg2+、NH4+、Cl-、K+、SO42-离子之间不发生反应,都不与氢离子反应;⑤使石蕊变红的溶液为酸性溶液,溶液中存在大量氢离子,硝酸根离子、高锰酸根离子能够氧化亚铁离子;⑥铁离子能够氧化碘离子、硫离子,铝离子能够与硫离子发生双水解反应.
易错点
注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等
知识点
11、 镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:xMg+Mo3S4 
正确答案
解析
:A.原电池工作时,阳离子向正极移动,故A错误;B.电池放电时,正极发生还原反应,由总方程式可知,Mo3S4为正极,被还原,电极反应为Mo3S4+2xe-+xMg2+═MgxMo3S4,故B正确;C.充电时,Mg为阴极,被还原,电极反应为电极方程式为xMg2++2xe-═xMg,故C错误;D.电池充电时,阳极反应为MgxMo3S4-2xe-═Mo3S4+xMg2+,故D错误.
考查方向
解题思路
放电时,Mg被氧化,为原电池的负极,电极反应为xMg-2xe-═xMg2+,Mo3S4为正极,被还原,电极反应为Mo3S4+2xe-+xMg2+═MgxMo3S4,充电是电能转化为化学能的过程,阴极反应和原电池负极相反,发生还原反应,以此解答该题.
易错点
注意根据电池总反应书写电极反应式,此为解答该题的关键.
知识点
13.已知如下物质的溶度积常数:FeS:Ksp=6.3×10-18;CuS:Ksp=1.3×10-36;
ZnS:Ksp=1.6×10-24。下列说法正确的是( )
正确答案
解析
A.ZnS与CuS的化学式形式相同,可以直接通过溶度积常数比较二者的溶解度,Ksp越小,溶解度越小,故A错误;B.将足量CuSO4溶解在0.1 mol•L-1的H2S溶液中,生成CuS沉淀后,溶液为硫酸铜溶液,Cu2+的最大浓度应为饱和溶液的浓度,故B错误;C.由于CuS是难溶于酸的沉淀,反应符合复分解条件,能发生,故C错误;D.FeS的溶度积大于CuS的溶度积,其溶解平衡的S2-浓度远大于CuS的S2-离子浓度,故加入FeS可以沉淀废水中的Cu2+,故D正确.
考查方向
解题思路
三种物质的化学式形式相同,可以直接通过溶度积常数比较二者的溶解度,根据溶度积常数计算溶液中的离子浓度,从溶解平衡移动的角度分析.
易错点
注意把握溶度积的定义的理解和计算的应用,易错点为B.
知识点
14、部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:
下列说法正确的是( )
正确答案
解析
:A.滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,其物质的量=3.2g/160g/mol=0.02mol,铁元素的物质的量为0.04mol,滤液A中溶质为过量H2SO4和FeSO4,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,合金中Fe元素质量=0.04mol×56g/mol=2.24g,故合金中氧原子的物质的量5.76g−3.2g−2.24g/16g/mol=0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08mol-0.04mol=0.04mol H+生成氢气,即生成0.02mol氢气,标况体积=0.02mol×22.4L/mol=0.448L=448mL,故A错误;
B.合金中Fe元素的质量为:56g/mol×0.04mol=2.24g,故合金中Fe元素质量分数=2.24g/5.76g×100%=38.89%,故B正确;C.由于氧化性Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且硫酸足量,滤液A中阳离子为:Fe2+、H+,故C错误
D.由于硫酸过量,生成氢气,滤液中不含铜离子,滤渣3.2g为金属铜,铜元素的物质的量为3.2g/64g/mol=0.05mol,若全部为氧化铜,氧化铜的质量为:80g/mol×0.05mol=4.0g,由于部分铜被氧化成氧化铜,则样品中氧化铜的质量一定小于4.0g,故D错误;
考查方向
解题思路
A.滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,物质的量为0.02mol,铁元素的物质的量为0.04mol,滤液A溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.04mol,说明参加反应硫酸物质的量为0.04mol,硫酸含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,计算合金中氧元素的质量,进而计算合金中氧原子的物质的量,计算氧原子结合氢离子物质的量,再根据H原子守恒生成氢气的体积;B.结合A根据质量分数定义计算Fe元素质量分数;
C.硫酸足量,氧化性:Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且有气体氢气生成,则滤液A中不含铁离子;D.滤渣3.2g为金属铜,物质的量为0.05mol,即合金样品中总共含有铜元素0.05mol,利用极限法判断样品中CuO的质量问题.
易错点
注意利用极限法与原子守恒解答
知识点
12、已知NH4CuSO3与足量的10mol/L硫酸液混合微热,产生下列现象:
①有红色金属生成
②产生刺激性气味的气体
③溶液呈现蓝色
据此判断下列说法正确的是( )
正确答案
解析
反应的发产生为:2NH4CuSO3+4H+═Cu+Cu2++2SO2↑+2H2O+2NH4+.A、由发产生为:2NH4CuSO3+4H+═Cu+Cu2++2SO2↑+2H2O+2NH4+,反应只有Cu元素的化合价发生变化,硫酸根反应前后未变,反应中硫酸体现酸性,不作氧化剂,故A错误;B、NH4CuSO3与硫酸混合微热,生成红色固体物、产生有刺激性气味的气体和蓝色溶液,说明反应生成Cu、SO2和Cu2+,反应前后S元素的化合价没有发生变化,故B错误;C、因反应是在酸性条件下进行,不可能生成氨气,故C错误.D、反应只有Cu元素的化合价发生变化,分别由+1→+2,+1→0,反应的发产生为:2NH4CuSO3+4H+═Cu+Cu2++2SO2↑+2H2O+2NH4+,每2molNH4CuSO3参加反应则转移1mol电子,则1molNH4CuSO3完全反应转移0.5mol电子,故D正确.
考查方向
解题思路
NH4CuSO3与硫酸混合微热,生成红色固体物、产生有刺激性气味的气体和蓝色溶液,说明反应生成Cu、SO2和Cu2+,则NH4CuSO3中Cu的化合价为+1价,以此解答该题.
易错点
注意从反应现象判断生成物,结合化合价的变化计算电子转移的数目.
知识点
【科目】化学
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下:
请回答:
19.已知Fe(CrO2)2中铬元素是+3价,则Fe(CrO2)2中铁元素是 价。
20.化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
21.煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:
4Fe(CrO2)2+8Na2CO3+7O2
为了加快该反应的反应速率,可采取的措施是 。
22.已知CrO42—在不同的酸性溶液中有不同的反应,如:
2CrO42- + 2H+ 

①往混合溶液甲中加入硫酸必须适量的原因是 。
②混合溶液乙中溶质的化学式是 。
23.+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌,所以制取红矾钠后的废水中含有的Cr2O72—必须除去。工业上可用电解法来处理含Cr2O72—的废水,下图为电解装置示意图(电极材料分别为铁和石墨)。通电后,Cr2O72—在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr( OH)3沉淀而被除去。
a电极的电极反应式是 ,
b电极附近反应的离子方程式是 。
正确答案
+2
解析
:Fe(CrO2)2中,氧元素的化合价是-2价,总的负价是-8价,铬元素的化合价是+3价,2个铬原子化合价是+6价,所以铁元素化合价是+2价,
故答案为:+2
考查方向
解题思路
根据正负总化合价之和相等进行分析;
易错点
重铬酸钠的制取原理及除杂方法,涉及了电极知识的应用
正确答案
FeO·Cr2O3
解析
:Fe(CrO2)2 中铁元素化合价是+2价,氧化物为FeO,铬元素化合价+3价,氧化物为Cr2O3,所以Fe(CrO2)2写成氧化物形式为FeO•Cr2O3,故答案为:FeO•Cr2O3 ;
考查方向
解题思路
类比Na2SiO3可写成Na2O•SiO2完成Fe(CrO2)2的氧化物的形式;
易错点
重铬酸钠的制取原理及除杂方法,涉及了电极知识的应用
正确答案
粉碎矿石,升高温度。
解析
: 增大反应物接触面积可以加快反应速率,升高温度可以大大加快反应速率,
故答案为:粉碎矿石、升高温度;
考查方向
解题思路
根据影响化学反应速率的因素分析;
易错点
重铬酸钠的制取原理及除杂方法,涉及了电极知识的应用
正确答案
① 少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物。
② Na2Cr2O7和Na2SO4
解析
:①由于少量难以除尽碳酸钠,过量会发生反应3CrO42-+4H+=Cr3O102-+2H2O,生成了Na2Cr3O10等副产物,所以必须加入适量硫酸,故答案为:少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物;②由于发生了反应2CrO42-+2H+=Cr2O72-+H2O,生成了Na2Cr2O7和Na2SO4,所以乙中溶质的化学式Na2Cr2O7和Na2SO4,故答案为:Na2Cr2O7和Na2SO4;
考查方向
解题思路
①固体图示及题中信息可知,少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物;②发生了反应2CrO42-+2H+=Cr2O72-+H2O,生成了Na2Cr2O7和Na2SO4;
易错点
重铬酸钠的制取原理及除杂方法,涉及了电极知识的应用
正确答案
2H+ + 2e- = H2↑,Cr2O
解析
:根据电解槽图示可知,a为阴极,溶液显示酸性,溶液中氢离子得到电子,发生还原反应,电极反应为:2H++2e-=H2↑,
b为阳极,铁失去电子生成亚铁离子,亚铁离子被Cr2O72-氧化成铁离子,反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:2H++2e-=H2↑,Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
考查方向
解题思路
a连接电源负极,所以a为阴极;b连接电源正极,所以b为电解槽的阳极;阳极发生氧化反应,阴极发生还原反应.
易错点
重铬酸钠的制取原理及除杂方法,涉及了电极知识的应用
【科目】化学
为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g) + O2(g) 
② C和C0的燃烧热(△H)分别为-393.5 kJ·mol-1和-283 kJ·mol-1
15.则2NO(g) + 2CO(g) 
17.烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=________(用含硫微粒浓度的代数式表示)。
18.通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1 mol

正确答案
-746.5
解析
:①N2(g)+O2(g)═2NO(g)△H1=+180.5kJ•mol-1
②C的燃烧热(△H)为-393.5kJ•mol-1,热化学方程式为C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1;
③C0的燃烧热283kJ•mol-1 ,热化学方程式为CO(g)+0.5O2(g)=CO2(g)△H=-283kJ•mol-1;
依据盖斯定律计算③×2-①得到,2NO(g)+2CO(g)═N2(g)+2CO2(g)的△H=-746.5KJ/mol
故答案为:-746.5;
考查方向
解题思路
写出C和CO燃烧热的热化学方程式,结合盖斯定律计算所需要的热化学方程式;
易错点
热化学方程式书写方法,化学平衡建立,平衡状态影响因素分析,化学反应速率、平衡常数计算应用,电解质溶液电荷守恒,弱电解质电离平衡的计算应用
正确答案
2c(SO

解析
: 烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,依据溶液中电荷守恒分析,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),c(H+)=c(OH-),得到(Na+)=2c(SO32-)+c(HSO3-),故答案为:2c(SO32-)+c(HSO3-);
考查方向
解题思路
依据溶液中存在的电荷守恒分析;
易错点
热化学方程式书写方法,化学平衡建立,平衡状态影响因素分析,化学反应速率、平衡常数计算应用,电解质溶液电荷守恒,弱电解质电离平衡的计算应用
正确答案
1.0×10-7
解析
:常温下,0.1mol/L的HCOONa溶液pH为10,溶液中存在HCOO-水解HCOO-+H2O⇌HCOOH+OH-,故Kh=10−4×10−4/0.1−10−4=10-7,则HCOOH的电离常数Ka=Kw/Kh=10−14/10−7=1×10-7,故答案为:1.0×10-7
考查方向
解题思路
计算水解平衡常数Kh,再根据Ka=Kw/Kh计算.
易错点
热化学方程式书写方法,化学平衡建立,平衡状态影响因素分析,化学反应速率、平衡常数计算应用,电解质溶液电荷守恒,弱电解质电离平衡的计算应用
【科目】化学
某化学研究小组探究无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解的产物,并对所得气体产物和固体产物进行验证,按下图装置进行实验(夹持仪器已略去)。
24.连接好装置后,加入药品前,应该进行的实验操作是________________(填操作名称)。
25.实验开始时缓缓通入氮气,过一段时间以后,加热反应管A和E ,待反应完全后,停止加热,仍继续通氮气,直到反应管冷却。停止加热前是否需要先断开A、B的连接处和E、F的连接处?为什么?
_______________________________________________________________。
26.实验中观察到B中澄清石灰水变浑浊,则说明气体产物中有
(写化学式)。能证明分解产物中有CO气体生成的实验现象是 。
27.该小组同学查阅资料后得知,固体产物中不存在+3价Fe元素,而盐类物质只有K2CO3。
① 验证固体产物中钾元素存在的方法是 ,
现象是 。
② 研究小组为探究铁元素的存在形式,取A中充分反应后所得固体于试管中,加入足量蒸馏水,过滤、洗涤、干燥得到黑色粉末,取4.4g黑色粉末溶于足量稀硝酸中,收集到标准状况下NO气体1.12L通过计算判断黑色粉末的成分为 (写化学式)。写出黑色粉末溶于足量稀硝酸发生反应的离子方程式: 。
正确答案
检查装置的气密性
考查方向
解题思路
探究无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解的产物:连接好装置后,加入药品前,应该进行的实验操作是检验装置气密性,利用氮气提供惰性环境,避免干扰分解产物的分析和验证,装置A:无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解,装置B:将气体产物通过澄淸石灰水,观察到澄清石灰水变浑浊,有CO2生成,装置C:用氢氧化钠将CO2除尽,装置D:净化(干燥)剩余产物气体,装置E:检验CO(用CuO,变红),装置F:检验有CO2生成(CO的氧化产物).分析装置图可知,利用氮气提供惰性环境,避免干扰分解产物的分析和验证,加入药品前,应该进行的实验操作是检验装置气密性;【解析】:装置图分析可知,利用生成氮气提供惰性环境,避免干扰分解产物的分析和验证,加入药品前,应该进行的实验操作是检查装置气密性检查,
故答案为:检查装置气密性检查;
易错点
元素及其化合物性质、离子方程式书写等知识
正确答案
不需要 因为N2不断通入,B、F瓶溶液不会倒吸。
解析
: 实验结束后,需要继续通入氮气直到玻璃管冷却,氮气气体进入B和F中溶液中,所以不会出现倒吸现象,故答案为:否;因为N2不断通入,B、F瓶溶液不会倒吸;
考查方向
解题思路
探究无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解的产物:连接好装置后,加入药品前,应该进行的实验操作是检验装置气密性,利用氮气提供惰性环境,避免干扰分解产物的分析和验证,装置A:无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解,装置B:将气体产物通过澄淸石灰水,观察到澄清石灰水变浑浊,有CO2生成,装置C:用氢氧化钠将CO2除尽,装置D:净化(干燥)剩余产物气体,装置E:检验CO(用CuO,变红),装置F:检验有CO2生成(CO的氧化产物).根据实验结束后,需要继续通入氮气直到玻璃管冷却来分析;
易错点
元素及其化合物性质、离子方程式书写等知识
正确答案
CO2 E中黑色固体变成红色,F中溶液变浑浊
解析
:B中是澄清石灰水,生成沉淀证明生成二氧化碳,证明一氧化碳生成可以利用装置E中黑色固体变成红色,F中溶液变浑浊,说明一氧化碳还原氧化铜反应生成二氧化碳通过F澄清石灰水变浑浊,故答案为:CO2;E中黑色固体变成红色,F中溶液变浑浊;
考查方向
解题思路
探究无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解的产物:连接好装置后,加入药品前,应该进行的实验操作是检验装置气密性,利用氮气提供惰性环境,避免干扰分解产物的分析和验证,装置A:无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解,装置B:将气体产物通过澄淸石灰水,观察到澄清石灰水变浑浊,有CO2生成,装置C:用氢氧化钠将CO2除尽,装置D:净化(干燥)剩余产物气体,装置E:检验CO(用CuO,变红),装置F:检验有CO2生成(CO的氧化产物).B中是澄清石灰水,生成沉淀证明生成二氧化碳,证明一氧化碳生成可以利用装置E中黑色固体变成红色,F中溶液变浑浊,说明一氧化碳还原氧化铜反应生成二氧化碳通过F澄清石灰水变浑浊;
易错点
元素及其化合物性质、离子方程式书写等知识
正确答案
焰色反应 透过蓝色的钴玻璃观察到紫色火焰 ;FeO 和Fe 3FeO +10H+ +NO3-=3Fe3++NO↑+5H2O;Fe+4H+ +NO3-=Fe3++NO↑+2H2O
解析
:①验证固体产物中钾元素存在的实验方法用焰色反应,但必须要透过蓝色的钴玻璃观察到紫色火焰,故答案为:焰色反应;透过蓝色的钴玻璃观察到紫色火焰;②标况下1.12L一氧化氮的物质的量为:n(NO)=1.12L/22.4L/mol=0.05mol,生成0.05mol电子需要转移的电子的物质的量为:(5-2)×0.05mol=0.15mol,根据电子守恒,如果固体完全为铁,则固体的质量为:56gmol×=2.8g;如果固体为FeO,则固体的质量为:72g/mol×0.15mol/3−2=10.8g,所以4.4g为Fe和FeO的混合物,Fe与硝酸反应的离子方程式为:3FeO+NO3-+10H+═3Fe3++5H2O+NO↑,FeO与硝酸反应的离子方程式为:Fe+NO3-+4H+═Fe3++2H2O+NO↑,故答案为:Fe和FeO;3FeO+NO3-+10H+═3Fe3++5H2O+NO↑、Fe+NO3-+4H+═Fe3++2H2O+NO↑.
考查方向
解题思路
探究无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解的产物:连接好装置后,加入药品前,应该进行的实验操作是检验装置气密性,利用氮气提供惰性环境,避免干扰分解产物的分析和验证,装置A:无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解,装置B:将气体产物通过澄淸石灰水,观察到澄清石灰水变浑浊,有CO2生成,装置C:用氢氧化钠将CO2除尽,装置D:净化(干燥)剩余产物气体,装置E:检验CO(用CuO,变红),装置F:检验有CO2生成(CO的氧化产物).①验证固体产物中钾元素存在的实验方法用焰色反应,但必须要透过蓝色的钴玻璃观察到紫色火焰来判断;②先根据n=V/Vm计算出NO的物质的量,再根据化合价变化计算出生成一氧化氮转移的电子的物质的量,然后利用极值法和电子守恒判断4.4g固体的组成,最后写出反应的离子方程式.
易错点
元素及其化合物性质、离子方程式书写等知识
【科目】化学
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
28.煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和________。
29.在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为
第二步反应的离子方程式为____________________。
30.工业煤干馏得到的产品有焦炭、________。
31.工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是__________________________________________。
正确答案
直接液化技术 间接液化技术
解析
:煤的液化分为直接液化和间接液化,故答案为:直接液化技术;间接液化技术;
考查方向
解题思路
煤的液化分为直接液化和间接液化;
易错点
煤的综合利用,涉及到氧化还原方程式的书写
正确答案
2FeS2+7O2+2H2O
4Fe2++O2+4H+
解析
:第一步反应中反应物有FeS2、O2和H2O,生成物有Fe2+和SO42-,根据化合价升降总数相等以及原子守恒,反应的离子方程式为:2FeS2+7O2+2H2O=4H++2Fe2++4SO42-;Fe2+具有还原性,可被氧气氧化为Fe3+,根据化合价升降总数相等以及原子守恒,反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,故答案为:2FeS2+7O2+2H2O=4H++2Fe2++4SO42-;4Fe2++O2+4H+=4Fe3++2H2O;
考查方向
解题思路
根据化合价升降总数相等以及原子守恒来写离子方程式;
易错点
煤的综合利用,涉及到氧化还原方程式的书写
正确答案
焦炉煤气、粗氨水、煤焦油
解析
:工业煤干馏得到的产品有焦炭、焦炉煤气、粗氨水、煤焦油;故答案为:焦炉煤气、粗氨水、煤焦油;
考查方向
解题思路
工业煤干馏得到的产品有焦炭、焦炉煤气、粗氨水、煤焦油;
易错点
煤的综合利用,涉及到氧化还原方程式的书写
正确答案
1.25;O2太少不利于NH3的转化,r值为2.2时NH3氧化率已近100%
解析
:由氨氧化的化学方程式:4NH3+5O2----4NO+6H2O,可知氨氧化率达到100%,理论上γ{n(O2)/n(NH3)}=5/4=1.25,故答案为:1.25;
O2浓度太少不利于NH3的转化,γ{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%,故答案为:O2浓度太少不利于NH3的转化,γ{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%;
考查方向
解题思路
根据氨氧化的化学方程式来分析;根据O2浓度对平衡的影响;
易错点
煤的综合利用,涉及到氧化还原方程式的书写









