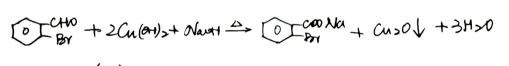
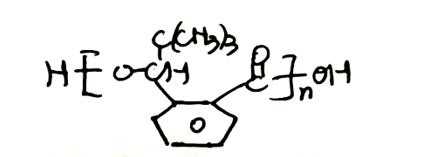
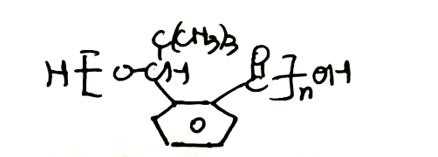
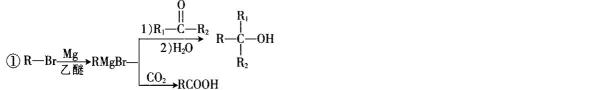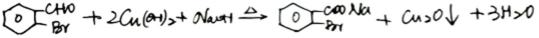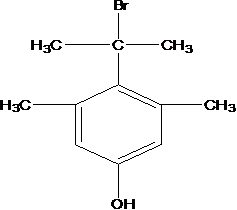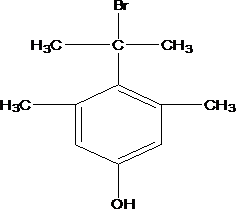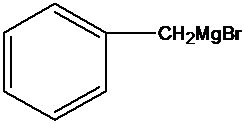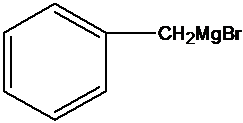- 真题试卷
- 模拟试卷
- 预测试卷
4.下列不正确的是()
正确答案
解析
根据离子的电荷守恒,c(Na+)+c(K+)+c(H+)=c(OH- )+c(CH3COO-)+c(Cl-),因为KCl是强电解质,因为c(K+)=c(Cl-),所以c(Na+)-c(CH3COO-)=c(OH-)-c(H+),故A正确;
相同浓度CH3COONa和NaClO的混合液中,CH3COOH较HClO的酸性强,因此CH3COO-较ClO-电离程度大,因此各离子浓度的大小关系是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),故B错误;
如果HA是强酸,则消耗HA的溶液体积是10ml。如果HA弱酸,则消耗HA的溶液体积小于10ml,故C正确;
因为是恰好反应,所以产物恰好生成NH4Cl,即c(NH4+)+c(NH3•H2O)+c(NH3)=c(Cl- )=0.1/2=0.05mol/l,故D正确。
考查方向
解题思路
A:根据离子的电荷守恒,c(Na+)+c(K+)+c(H+)=c(OH- )+c(CH3COO-)+c(Cl-),因为KCl是强电解质,因此c(K+)=c(Cl-),所以c(Na+)-c(CH3COO-)=c(OH-)-c(H+);
B:相同浓度CH3COONa和NaClO的混合液中,CH3COOH较HClO的酸性强,因此CH3COO-较ClO-电离程度大,因此各离子浓度的大小关系是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+);
C:如果HA是强酸,则消耗HA的溶液体积是10ml。如果HA弱酸,则消耗HA的溶液体积小于10ml;
D:因为是恰好反应,所以产物恰好生成NH4Cl,即c(NH4+)+c(NH3•H2O)+c(NH3)=c(Cl- )=0.1/2=0.05mol/l
易错点
忽略溶液的酸碱性,对弱酸、弱碱的性质理解不够透彻
知识点
1.化学与社会、科学、技术、环境、生活等有密切关系,下列说法正确的是()
正确答案
解析
纯净水中缺少一些人体必需的微量元素,所以长期饮用纯净水,有可能引起一些微量元素缺乏症,故A正确;
明矾不能杀菌消毒,故B错误;
洗涤剂去污是乳化作用从而去污;纯碱水解显碱性,促进油污的水解,从而去污,二者去污原理使石蕊呈红色的溶液,显酸性,离子之间发生氧化还原反应不相同,故C错误;
人体没有水解纤维素的酶,纤维素不能在人体内水解成葡萄糖,故D错误。
考查方向
解题思路
A:纯净水中缺少一些人体必需的微量元素,长期饮用纯净水,有可能引起一些微量元素缺乏症;
B:明矾不能杀菌消毒;
C:洗涤剂去污是乳化作用从而去污;纯碱水解显碱性,促进油污的水解,从而去污,二者去污原理使石蕊呈红色的溶液,显酸性,离子之间发生氧化还原反应不相同;
D:人体没有水解纤维素的酶,纤维素不能在人体内水解成葡萄糖。
易错点
对化学在社会、科学、技术、环境、生活等中的基本应用理解不透彻
知识点
2.下列说法不正确的是()
正确答案
解析
Na+、SO42-、Fe3+、MnO4-之间不反应,在溶液中可以大量共存,故A正确;
晶体中HSO4-不电离,故只有0.1mol阳离子,即K+,因此阳离子所带电荷数为NA ,故B正确;
235U和238U质子数相同、中子数不同,互为同位素,化学性质基本相同,235U转化成238U是核反应,不属于化学变化,故C正确;
元素O、S、P的气态氢化物热稳定性依据非金属性判断,应该以此递减,故D错误。
考查方向
解题思路
A:Na+、SO42-、Fe3+、MnO4-之间不反应,在溶液中可以大量共存;
B:晶体中HSO4-不电离,故只有0.1mol阳离子,即K+,因此阳离子所带电荷数为NA;
C:235U和238U互为同位素,化学性质基本相同,235U转化成238U是核反应,不属于化学变化;
D:元素O、S、P的气态氢化物热稳定性依据非金属性判断,应该以此递减。
易错点
忽略离子共存的溶液条件;对阿伏伽德罗理解不透彻,对同位素及元素周期律概念混淆;
知识点
3.下列有关实验原理、操作及安全知识的叙述,正确的是()
正确答案
解析
形成溶液后,污染面积更大,故A错误;
银氨溶液应现用现配,放置时间过长会发生变质,氢氧化铜悬浊液应现用现配,放置时间过长会变为沉淀,氯水能与水反应生成次氯酸,次氯酸见光易分解,放置时间过长会变为沉淀,故B正确;
氯代烃在碱性条件下水解,如直接加入硝酸银生成氢氧化银沉淀而干扰实验现象,应先酸化,故C错误;
NaOH是强碱,HClO、CH3COOH是弱酸,因此它们产生的盐都是强碱弱酸盐,水解使溶液显碱性。但是NaClO溶液水解产生的HClO有漂白性,因此不能通过用PH试纸测定溶液的pH比较HClO和CH3COOH的酸性强弱,故D错误。
考查方向
解题思路
A:形成溶液后,污染面积更大;
B:银氨溶液应现用现配,放置时间过长会发生变质,氢氧化铜悬浊液应现用现配,放置时间过长会变为沉淀,氯水能与水反应生成次氯酸,次氯酸见光易分解,放置时间过长会变为沉淀;
C:氯代烃在碱性条件下水解,如直接加入硝酸银生成氢氧化银沉淀而干扰实验现象,应先酸化,故C错误;
D:NaOH是强碱,HClO、CH3COOH是弱酸,因此它们产生的盐都是强碱弱酸盐,水解使溶液显碱性。但是NaClO溶液水解产生的HClO有漂白性,因此不能通过用PH试纸测定溶液的pH比较HClO和CH3COOH的酸性强弱。
易错点
对化学原理、操作及安全知识理解不透彻,易混淆
知识点
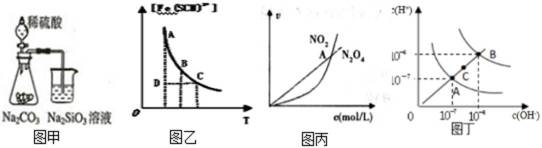
5.下列各示意图与对应表述正确的是()
正确答案
解析
比较非金属性,可根据元素对应的最高价氧化物的水化物的酸性强弱比较,硫酸与碳酸钠反应生成二氧化碳,二氧化碳气体通入硅酸钠溶液中可得硅酸沉淀,可证明非金属性的强弱,故A正确;
反应处于D点时,从横坐标看T1温度下对应的平衡状态Fe(SCN)2+浓度比D点高,所以D点还未达到平衡,v(正)>v(逆),故B错误;
乙表示恒温恒容条件下发生的可逆反应2NO2(g)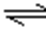
从A点到C点水的离子积常数是增大的,所以改变的条件应该是升高温度,故D错误。
考查方向
解题思路
A:比较非金属性,可根据元素对应的最高价氧化物的水化物的酸性强弱比较,硫酸与碳酸钠反应生成二氧化碳,二氧化碳气体通入硅酸钠溶液中可得硅酸沉淀,可证明非金属性的强弱;
B:反应处于D点时,从横坐标看T1温度下对应的平衡状态Fe(SCN)2+浓度比D点高,所以D点还未达到平衡,v(正)>v(逆);
C:乙表示恒温恒容条件下发生的可逆反应2NO2(g)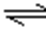
D:从A点到C点水的离子积常数是增大的,所以改变的条件应该是升高温度。
易错点
对非金属性强弱比较理解不透彻;对可逆反应及其相关知识理解不透彻;
知识点
6. 利用化石燃料开采、加工过程产生的H2S废气,通过电化学法制取氢气的工艺如图,下列说法不正确的是()
正确答案
解析
C1极生成Fe3+,应发生氧化反应,为阳极,C2极生成氢气,为阴极,发生还原反应,故A正确;
电解池中生成的FeCl3可作为反应池的反应物,则FeCl3溶液可循环利用,故B正确;
由装置可知反应池中的反应物为H2S和FeCl3,生成物S和Fe2+,则反应的化学方程式为H2S+2FeCl3=2FeCl2+S↓+2HCl,离子方程式为2Fe3++H2S=2Fe2++S↓+2H+,故C错误;
反应池中发生氧化还原反应为H2S+2FeCl3=2FeCl2+S↓+2HCl,电解池中亚铁离子失去电子,氢离子得到电子,电解总反应的离子方程式为Fe+2HCl═FeCl2+H2↑,故D正确。
考查方向
解题思路
A:C1极生成Fe3+,应发生氧化反应,为阳极,C2极生成氢气,为阴极,发生还原反应;
B:电解池中生成的FeCl3可作为反应池的反应物,则FeCl3溶液可循环利用;
C:由装置可知反应池中的反应物为H2S和FeCl3,生成物S和Fe2+,则反应的化学方程式H2S+2FeCl3=2FeCl2+S↓+2HCl,离子方程式为2Fe3++H2S=2Fe2++S↓+2H+;
D:反应池中发生氧化还原反应为H2S+2FeCl3=2FeCl2+S↓+2HCl,电解池中亚铁离子失去电子,氢离子得到电子,电解总反应的离子方程式为Fe+2HCl═FeCl2+H2↑
易错点
对正负极,阴阳极判断不正确
知识点


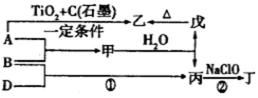
7.A在元素周期表中的位置 A、B单质对应元素的简单离子半径
8.丙的电子式为 ,丁中所包含的化学键类型有 (填字母序号)。
a.离子键
b.极性共价键
c.非极性共价键
9.甲和水反应生成戊和丙的化学方程式为 。
10.一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC)。已知该反应生成1mol乙时放出536kJ热量,其热化学方程式为 。
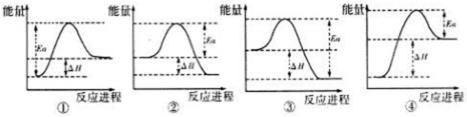
11.已知另有物质己为中学常见黑色磁性氧化物,能够与A在一定条件下发生反应,实验测得与A反应的焓变(△H)和活化能(Ea)。下列能量关系图合理的是 (填写序号)。
12.资料显示物质己可用于除去地下水中的TcO4— (99Tc具有放射性)。在弱酸性条件下,物质己将TcO4— 转化为难溶于水的TcO2,同时得到一种难溶于水的弱碱,该反应的离子方程式为 。
正确答案
第三周期ⅢA族 N3->Al3+
解析
组成B的元素为Al元素,位于元素周期表中第3周期第ⅢA族;A为Al,B为N2;A、B单质对应元素的简单离子半径
考查方向
解题思路
A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体,则丙为NH3;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子,则丁为N2H4;戊是一种难溶于水的白色胶状物质,既能与强酸反应也能与强碱反应,具有净水作用,戊为Al(OH)3;结合转化关系图可知,氢氧化铝分解生成氧化铝和水,则乙为氧化铝,所以A为Al;B为N2,甲为氮化铝,C为H2
易错点
对元素周期表及其相关知识的混淆理解,对方程式推导、书写错误
正确答案
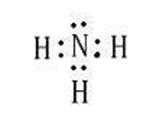
解析
丙为NH3,因此丙的电子式为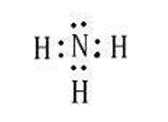
考查方向
解题思路
A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体,则丙为NH3;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子,则丁为N2H4;戊是一种难溶于水的白色胶状物质,既能与强酸反应也能与强碱反应,具有净水作用,戊为Al(OH)3;结合转化关系图可知,氢氧化铝分解生成氧化铝和水,则乙为氧化铝,所以A为Al;B为N2,甲为氮化铝,C为H2
易错点
对元素周期表及其相关知识的混淆理解,对方程式推导、书写错误
正确答案
AlN +3H2O = Al(OH)3+ NH3↑
解析
甲和水反应生成戊和丙的化学方程式AlN +3H2O = Al(OH)3+ NH3↑
考查方向
解题思路
A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体,则丙为NH3;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子,则丁为N2H4;戊是一种难溶于水的白色胶状物质,既能与强酸反应也能与强碱反应,具有净水作用,戊为Al(OH)3;结合转化关系图可知,氢氧化铝分解生成氧化铝和水,则乙为氧化铝,所以A为Al;B为N2,甲为氮化铝,C为H2
易错点
对元素周期表及其相关知识的混淆理解,对方程式推导、书写错误
正确答案
4Al(s)+ 3TiO2(s)+ 3C(s石墨) = 2Al2O3(s)+ 3TiC(s) △H=-1072KJ/mol
解析
一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC)。已知该反应生成1mol乙时放出536kJ热量,其热化学方程式为4Al(s)+ 3TiO2(s)+ 3C(
考查方向
解题思路
A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体,则丙为NH3;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子,则丁为N2H4;戊是一种难溶于水的白色胶状物质,既能与强酸反应也能与强碱反应,具有净水作用,戊为Al(OH)3;结合转化关系图可知,氢氧化铝分解生成氧化铝和水,则乙为氧化铝,所以A为Al;B为N2,甲为氮化铝,C为H2
易错点
对元素周期表及其相关知识的混淆理解,对方程式推导、书写错误
正确答案
②
解析
黑色磁性氧化物为Fe3O4,3Fe3O4+8Al=9Fe+4Al2O3 条件是高温,铝热反应是放热反应,②合理
考查方向
解题思路
A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体,则丙为NH3;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子,则丁为N2H4;戊是一种难溶于水的白色胶状物质,既能与强酸反应也能与强碱反应,具有净水作用,戊为Al(OH)3;结合转化关系图可知,氢氧化铝分解生成氧化铝和水,则乙为氧化铝,所以A为Al;B为N2,甲为氮化铝,C为H2
易错点
对元素周期表及其相关知识的混淆理解,对方程式推导、书写错误
正确答案
3Fe3O4 +TcO4-+H++13H2O= TcO2+9 Fe(OH)3
解析
物质己是Fe3O4,根据题意可得3Fe3O4 +TcO4-+H++13H2O= TcO2+9 Fe(OH)3
考查方向
解题思路
A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体,则丙为NH3;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子,则丁为N2H4;戊是一种难溶于水的白色胶状物质,既能与强酸反应也能与强碱反应,具有净水作用,戊为Al(OH)3;结合转化关系图可知,氢氧化铝分解生成氧化铝和水,则乙为氧化铝,所以A为Al;B为N2,甲为氮化铝,C为H2
易错点
对元素周期表及其相关知识的混淆理解,对方程式推导、书写错误
回答下列问题:
26.Ⅰ. 在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
A(g)
容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
回答下列问题:
(1)下列操作能提高A转化率的是________
A.升高温度
B.体系中通入A气体
C.通入稀有气体He,使体系压强增大到原来的5倍
D.若体系中的C为HCl,其它物质均难溶于水,滴入少许水
(2) 该反应的平衡常数的表达式K=________,前2小时C的反应速率是_______ mol·L-1·h-1
(3)平衡时A的转化率为___________
27.Ⅱ.(1)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得二甲胺(CH3)2NH。二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为 。
(2)甲醇合成二甲基甲酰胺的热化学方程式为:
2CH3OH(l)+NH3(g)+CO(g) 
若该反应在常温下能自发进行,则△H 0 (填“ > ”、“ <
(3)以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如下图所示。
电源负极为 (填“A”或“B"),写出阳极的电极反应式 。
正确答案
(1)AD
(2)
(3)0.70或70%
解析
(1)升高温度、若体系中的C为HCl,其它物质均难溶于水,滴入少许水能提高A转化率;
(2)因为D是固体,因此该反应的平衡常数的表达式K=
(3)设:平衡时A的变化量是y,
A(g)⇌2B(g)+C(g)+D(s)
初始量: 0.1 0 0
变化量: y 2y y
平衡量: 0.1−y 2y y
化学反应在20h时建立平衡,所以(0.1−y+2y+y)/0.1=2.4,解得y=0.07mol,故答案为:0.70或70%。
考查方向
可逆反应及其相关知识、电解池原理
解题思路
根据三行式计算化学反应中物质的转化率以及物质的体积分数。依据电子守恒计算。
易错点
对可逆反应理解不够透彻,对正负极以及阴阳极判断错误
正确答案
(1)c(Cl—)>c>c(H+)>c(OH—)
(2)<
(3)B 2CH3OH+CO-2e-=(CH3O)2CO+2H+
解析
(1)二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,[(CH3)2NH2+]离子水解溶液显酸性,据此判断溶液中各离子浓度大小为:c(Cl−)>c[(CH3)2NH2+]>c(H+)>c(OH−);故答案为:c(Cl−)>c[(CH3)2NH2+]>c(H+)>c(OH−);
(2) 甲醇合成二甲基甲酰胺的化学方程式为:2CH3OH+NH3+CO⇌(CH3)2NCHO+2H2O,该反应在常温下能自发进行,△S<0,△H−T△S<0则△H<0,故答案为:<;
(3)图分析可知氢离子移向阴极,则与此电极连接的B电极为负极,阳极上是甲醇和一氧化碳反应失电子发生氧化反应,电极反应为:2CH3OH+CO−2e−=(CH3O)2CO+2H+。
考查方向
可逆反应及其相关知识、电解池原理
解题思路
根据三行式计算化学反应中物质的转化率以及物质的体积分数。依据电子守恒计算。
易错点
对可逆反应理解不够透彻,对正负极以及阴阳极判断错误
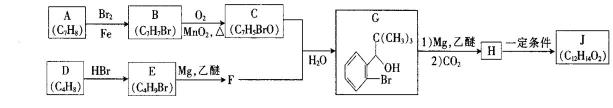
丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下
已知:
②E的核磁共振氢谱只有一组峰;
③C能发生银镜反应;
④J是一种酯,分子中除苯环外还含有一个五元环。
⑤苯环上的卤原子在常压下遇到NaOH溶液很难水解。
回答下列问题:
13.G中官能团的名称: 、 

14.D的系统命名是 ;J的结构简式为 。
15.由A生成B的化学方程式为 ,反应
16.C与新制的氢氧化铜悬浊液反应的化学方程式 。
17.H在一定条件下生成高分子化合物的结构简式为 。
18.G的同分异构体中核磁共振氢谱有4组峰且能与FeCl3溶液发生显色反应,任写出其中两种符合上述条件的的同分异构体的结构简式 。
19.由甲醛、化合物A与液溴为原料经下列步骤可得到2一苯基乙醇。
反应条件1为 ;反应条件2所选择的试剂为 ;L的结构简式为 。
正确答案
羟基、溴原子
解析
G中官能团的名称为羟基、溴原子
考查方向
解题思路
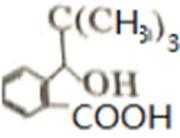
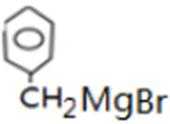
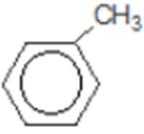
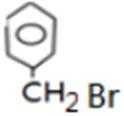
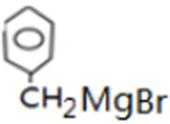
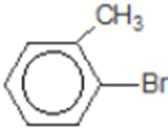
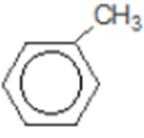
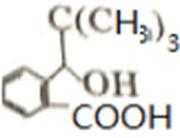
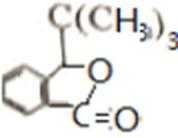
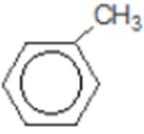
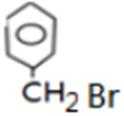
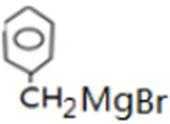
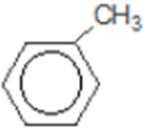
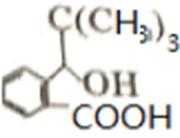
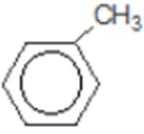
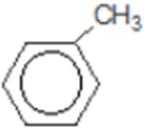
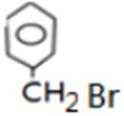
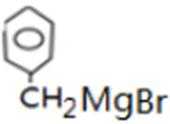
比较A、B的分子式可知,A与HBr发生加成反应生成B,B的核磁共振氢谱只有一组峰,则可知D为CH2=C(CH3)2,E为(CH3)3CBr,根据题中已知①可知F为(CH3)3CMgBr,C能发生银镜反应,同时结合G和F的结构简式可推知C为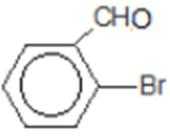
易错点
对有机物的推断错误;对其之间的变化性质理解不透彻
正确答案
2-甲基-1-丙烯 (2-甲基丙烯也可)
解析
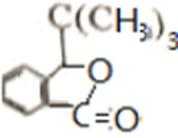
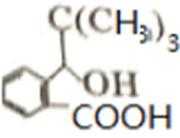
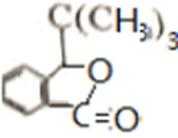
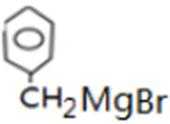
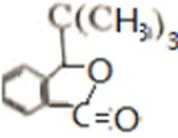
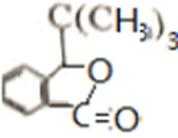
D的系统命名是2-甲基-1-丙烯 (2-甲基丙烯也可) ;J是一种酯,分子中除苯环外,还含有一个五元环,因此J的结构简式为
考查方向
解题思路
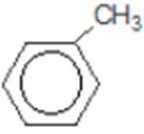
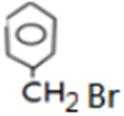
比较A、B的分子式可知,A与HBr发生加成反应生成B,B的核磁共振氢谱只有一组峰,则可知D为CH2=C(CH3)2,E为(CH3)3CBr,根据题中已知①可知F为(CH3)3CMgBr,C能发生银镜反应,同时结合G和F的结构简式可推知C为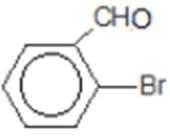
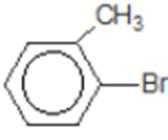
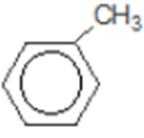
易错点
对有机物的推断错误;对其之间的变化性质理解不透彻
正确答案
取代
解析
A为
考查方向
解题思路
比较A、B的分子式可知,A与HBr发生加成反应生成B,B的核磁共振氢谱只有一组峰,则可知D为CH2=C(CH3)2,E为(CH3)3CBr,根据题中已知①可知F为(CH3)3CMgBr,C能发生银镜反应,同时结合G和F的结构简式可推知C为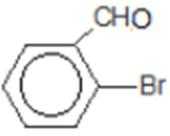
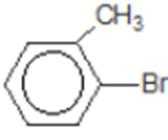
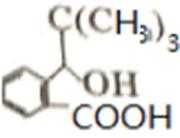
易错点
对有机物的推断错误;对其之间的变化性质理解不透彻
正确答案
解析
C与新制的氢氧化铜悬浊液反应的化学方程式
考查方向
解题思路
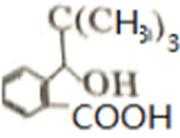
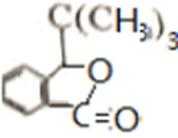
比较A、B的分子式可知,A与HBr发生加成反应生成B,B的核磁共振氢谱只有一组峰,则可知D为CH2=C(CH3)2,E为(CH3)3CBr,根据题中已知①可知F为(CH3)3CMgBr,C能发生银镜反应,同时结合G和F的结构简式可推知C为
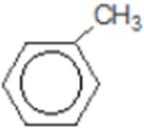
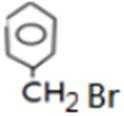

易错点
对有机物的推断错误;对其之间的变化性质理解不透彻
正确答案
解析
考查方向
解题思路
比较A、B的分子式可知,A与HBr发生加成反应生成B,B的核磁共振氢谱只有一组峰,则可知D为CH2=C(CH3)2,E为(CH3)3CBr,根据题中已知①可知F为(CH3)3CMgBr,C能发生银镜反应,同时结合G和F的结构简式可推知C为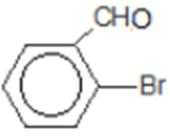
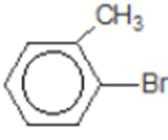
易错点
对有机物的推断错误;对其之间的变化性质理解不透彻
正确答案
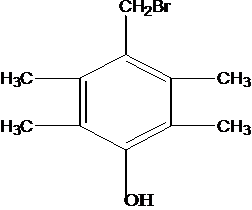
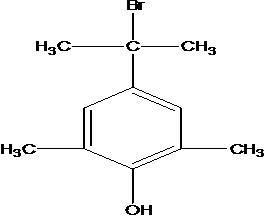
解析
G的同分异构体中核磁共振氢谱有4组峰且能与FeCl3溶液发生显色反应,说明有酚羟基,这样的结构为苯环上连有-OH、-CH2Br呈对位连结,另外还有四个-CH3基团,呈对称分布,或者是-OH、-C(CH3)2Br呈对位连结,另外还有2个-CH3基团,以-OH为对称轴对称分布,这样有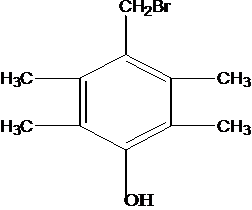
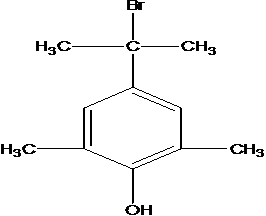
考查方向
解题思路
比较A、B的分子式可知,A与HBr发生加成反应生成B,B的核磁共振氢谱只有一组峰,则可知D为CH2=C(CH3)2,E为(CH3)3CBr,根据题中已知①可知F为(CH3)3CMgBr,C能发生银镜反应,同时结合G和F的结构简式可推知C为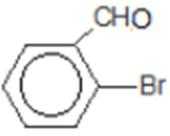
易错点
对有机物的推断错误;对其之间的变化性质理解不透彻
正确答案
光照
镁、乙醚
解析
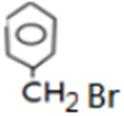
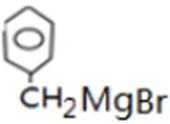
反应Ⅰ的为
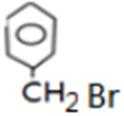
故答案为:Br2、光照;镁、乙醚;
考查方向
解题思路
比较A、B的分子式可知,A与HBr发生加成反应生成B,B的核磁共振氢谱只有一组峰,则可知D为CH2=C(CH3)2,E为(CH3)3CBr,根据题中已知①可知F为(CH3)3CMgBr,C能发生银镜反应,同时结合G和F的结构简式可推知C为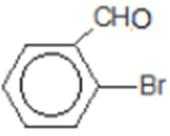

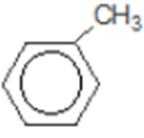
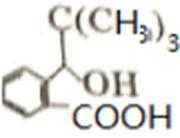
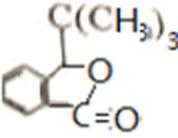
易错点
对有机物的推断错误;对其之间的变化性质理解不透彻
高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
实验流程如下:
已知K2MnO4溶液显绿色,KMnO4溶液紫红色。请回答下列问题:
20.步骤①应在 中熔化,并用铁棒用力搅拌,以防结块。
21.综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是 。
22.下列监控K2MnO4歧化完全的方法或操作可行的是 。
23.当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是 。
24.烘干时,温度控制在80℃为宜,温度不宜过高的理由是 。
25.通过用草酸滴定酸化后的KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①滴定过程溶液中发生的离子反应为 。
②称量w g KMnO4粗产品配制成100ml待测溶液,配制过程中除玻璃棒和烧杯外还需要用到的玻璃仪器有 、 。
③量取KMnO4待测液10.00ml,若该滴定管用蒸馏水洗净后未润洗,则测定结果将 。
④滴定终点溶液的颜色变化是 。
⑤经测定每滴定10.00ml待测液平均消耗c mol/L草酸标准液Vml,样品纯度的表达式为 (高锰酸钾摩尔质量用M表示)。
正确答案
解析
步骤①熔融固体需要在坩埚中进行,且熔融的物质和坩埚成分不反应,步骤①中含有KOH碱性物质,KOH能和SiO2反应生成硅酸钾,所以应该用铁坩埚熔融,故选D
考查方向
解题思路
根据流程图知,MnO2熔融氧化:3MnO2+KClO3+6KOH
易错点
对酸碱中和滴定实验理解不透彻,记忆混淆
正确答案
解析
①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂具有酸性,且和锰酸钾、高锰酸钾都不反应,稀盐酸和二氧化锰都能被酸性高锰酸钾溶液氧化,所以不能选取,硫酸酸性太强,可以选取醋酸,故选B
考查方向
解题思路
根据流程图知,MnO2熔融氧化:3MnO2+KClO3+6KOH
易错点
对酸碱中和滴定实验理解不透彻,记忆混淆
正确答案
解析
如果溶液中存在K2MnO4,通入CO2会产生沉淀,且K2MnO4溶液显绿色,KMnO4溶液紫红色,所以可以通过通入二氧化碳是否产生沉淀及溶液在滤纸上的颜色判断,故选B
考查方向
解题思路
根据流程图知,MnO2熔融氧化:3MnO2+KClO3+6KOH
易错点
对酸碱中和滴定实验理解不透彻,记忆混淆
正确答案
CO2与K2CO3溶液反应生成KHCO3,结晶时会同KMnO4一起结晶析出,产品纯度降低
解析
当溶液pH值达10~11时,停止通CO2;若CO2过多,二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低,故答案为:二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低。
考查方向
解题思路
根据流程图知,MnO2熔融氧化:3MnO2+KClO3+6KOH
易错点
对酸碱中和滴定实验理解不透彻,记忆混淆
正确答案
温度过高,产品受热分解
解析
如果温度过低,烘干时间过长,如果温度过高,会导致高锰酸钾分解,产率降低。
故答案为:如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解
考查方向
解题思路
根据流程图知,MnO2熔融氧化:3MnO2+KClO3+6KOH
易错点
对酸碱中和滴定实验理解不透彻,记忆混淆
正确答案
①2MnO4- + 5H2C2O4 +6H+=2Mn2+ + 10CO2↑ +8H2O
②100ml容量瓶 、 胶头滴管
③偏小
④溶液由红色变无色
⑤(cVM)/250W
解析
① 滴定过程中2MnO4-+5H2C2O4+6H+→10CO2↑+2Mn2++8H2O,注意草酸是弱酸,不能拆开;
②称量w g KMnO4粗产品配制成100ml待测溶液,配制过程中除玻璃棒和烧杯外还需要用到的玻璃仪器有100ml容量瓶 、 胶头滴管;
③酸式滴定管未用标准液润洗,滴定管内壁残余水分,稀释了KMnO4,使得KMnO4体积增大,由c(KMnO4)=c(H2C2O4)V(H2C2O4)/V(KMnO4)可知计算出的结果偏小;
④用草酸滴定酸化后的KMnO4溶液,滴定终点溶液的颜色变化是由紫红色(MnO4-)变为无色(Mn2+);
⑤根据c(KMnO4)=c(H2C2O4)V(H2C2O4)/V(KMnO4),因此c(KMnO4)=CV/10,因为c=n/v,n=m/M,且配制成100ml待测溶液,量取KMnO4待测液10.00ml,因此KMnO4的质量m=cVM,样品纯度的表达式为(cVM)/250W
考查方向
解题思路
根据流程图知,MnO2熔融氧化:3MnO2+KClO3+6KOH
易错点
对酸碱中和滴定实验理解不透彻,记忆混淆