- 真题试卷
- 模拟试卷
- 预测试卷
3.W是由短周期元素X、Y、Z组成的盐。X、Y、Z原子的最外层电子数依次增大,Z原子最外层电子数是内层电子数的3倍;X、Y原子最外层电子数之和等于Z原子的最外层电子数;Y、Z同周期且相邻,但与X不同周期。下列说法一定正确的是( )
正确答案
解析
W是由短周期元素X、Y、Z组成的盐,X、Y、Z原子的最外层电子数依次增大,Z原子最外层电子数是内层电子数的3倍,最外层电子数不超过8个,所以其内层为K层,则Z为O元素;X、Y原子最外层电子数之和等于Z原子的最外层电子数,则X和Y最外层电子数之和为6;Y、Z同周期且相邻,Y原子序数小于Z,所以Y是N元素,但Y与X不同周期,则X是H元素,则W是NH4NO3或NH4NO2,
A.主族元素最高正化合价等于其族序数,但O、F元素除外,所以这三种元素最高正化合价中Y的最大,故A错误
B.如果W是硝酸铵,为强酸弱碱盐,其水溶液呈酸性,故B错误;
C.原子电子层数越多其原子半径越大,同一周期元素,其原子半径随着原子序数增大而减小,所以原子半径Y>Z>X,故C错误;
D.Y是N元素,其最高价氧化物的水化物是硝酸,硝酸是强酸,故D正确;
考查方向
解题思路
W是由短周期元素X、Y、Z组成的盐,X、Y、Z原子的最外层电子数依次增大,Z原子最外层电子数是内层电子数的3倍,最外层电子数不超过8个,所以其内层为K层,则Z为O元素;X、Y原子最外层电子数之和等于Z原子的最外层电子数,则X和Y最外层电子数之和为6;Y、Z同周期且相邻,Y原子序数小于Z,所以Y是N元素,但Y与X不同周期,则X是H元素,则NH4NO3或NH4NO2,A.主族元素最高正化合价等于其族序数,但O、F元素除外;B.硝酸铵为强酸弱碱盐;C.原子电子层数越多其原子半径越大,同一周期元素,其原子半径随着原子序数增大而减小;D.Y是N元素,其最高价氧化物的水化物是硝酸.
易错点
对XYZ三种物质推断错误
知识点
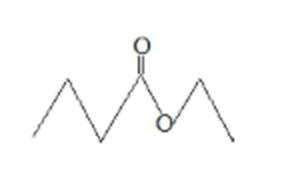
2.茅台酒中存在少量具有凤梨香味的物质X,其结构如右下图所示。下列说法正确的是( )
正确答案
解析
A.该物质中含有酯基,具有酯的性质,根据相似相溶原理知,该物质易溶于有机溶剂乙醇,故A错误;
B.该物质为丁酸乙酯,一定条件下能发生水解反应生成丁酸和乙醇,所以酒中的少量丁酸能抑制X水解,故B正确;
C.分子式为C4H8O2且官能团与X相同的物质中含有酯基,可能是甲酸正丙酯、甲酸异丙酯、乙酸乙酯、丙酸甲酯飞,符合条件的同分异构体有4种,故C错误;
D.该物质分子式为C6H12O2,根据原子守恒判断X完全燃烧生成二氧化碳和水的物质的量之比,X完全燃烧后生成CO2和H20的物质的量比为1:1,故D错误;
考查方向
解题思路
A.该物质中含有酯基,具有酯的性质,该物质易溶于有机溶剂;
B.该物质为丁酸乙酯,一定条件下能发生水解反应生成丁酸和乙醇;
C.分子式为C4H8O2且官能团与X相同的物质中含有酯基,可能是甲酸正丙酯、甲酸异丙酯、乙酸乙酯、丙酸甲酯;
D.该物质分子式为C6H12O2,根据原子守恒判断X完全燃烧生成二氧化碳和水的物质的量之比.
易错点
有机物性质的判断
知识点
1.中国丝绸有五千年的历史和文化。古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐,能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮。这种“碱剂”可能是( )
正确答案
解析
由题意可知,该物质是一种盐,水溶液呈碱性,为强碱弱酸盐。
A.食盐中氯化钠为强酸强碱盐,故A错误;
B.火碱是氢氧化钠,属于碱,故B错误;
C.草木灰中碳酸钾强碱弱酸盐,故C正确;
D.胆矾是硫酸铜晶体,是强酸弱碱盐,故D错误;
考查方向
解题思路
由题意可知,该物质是一种盐,水溶液呈碱性,为强碱弱酸盐来解答.
易错点
对碱物质认识不清
知识点
4.一定条件下,实验室利用右图所示装置,通过测电压求算 Ksp(AgCl)。工作一段时间后,两电极质量均增大。下列说法错误的是( )
正确答案
解析
A、该电池是原电池,将化学能转化为电能,故A正确;B、银失电子发生氧化反应为负极,而不是正极,故B错误;C、总的电极反应式为:Ag++Cl-═AgCl↓,故正确;D、阳离子向正极移动,左池是负极右池是正极,所以盐桥中的K+向右池方向移动,故D正确;故选B.
考查方向
解题思路
A、该电池是原电池;
B、银失电子发生氧化反应为负极;
C、总的电极反应式为:Ag++Cl-═AgCl↓;
D、阳离子向正极移动.
易错点
原电池正负极化学式的书写
知识点
5.室温下,0.1 mol·L−1 NaHCO3溶液的pH = 8.31,有关该溶液的判断正确的是( )
正确答案
解析
A.室温下,0.1mol•L-1NaHCO3溶液的pH=8.31,溶液呈碱性,说明HCO3-的水解程度大于电离程度,但其电离和水解程度都较小,水电离也生成氢氧根离子,钠离子不水解,所以离子浓度大小顺序是
c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),故A错误;B.Ka1(H2CO3)•Ka2(H2CO3)=c(H+).c(HCO3−)/C(H2CO3).c(H+).c(CO32−)/c(HCO3−),碳酸和碳酸氢根离子都部分电离,所以c(H+).c(HCO3−)/C(H2CO3)<c(H+),c(H+).c(CO32−)/c(HCO3−)<c(H+),因为室温下纯水中,c(OH-)=c(H+),所以Ka1(H2CO3)•Ka2(H2CO3)<KW,故B正确;C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),故C错误;D.任何电解质溶液中都存在物料守恒,未加NaOH时,根据物料守恒c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-),加入NaOH溶液时则存在c(Na+)>c(H2CO3)+c(HCO3-)+c(CO32-),故D错误
考查方向
解题思路
A.室温下,0.1mol•L-1NaHCO3溶液的pH=8.31,溶液呈碱性,说明HCO3-的水解程度大于电离程度,但其电离和水解程度都较小,水电离也生成氢氧根离子;
B.Ka1(H2CO3)•Ka2(H2CO3)=c(H+).c(HCO3−)/C(H2CO3).c(H+).c(CO32−)/c(HCO3−)
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.任何电解质溶液中都存在物料守恒,根据物料守恒判断.
易错点
对溶液中离子浓度判断不清
知识点
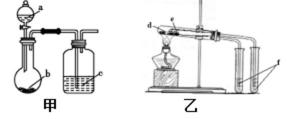
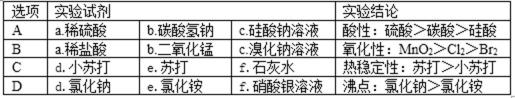
6.用下图所示装置进行实验,能得出相应实验结论的是( )
甲 乙
正确答案
解析
:A..强酸能弱酸盐反应生成弱酸,根据强酸制取弱酸判断酸性强弱,稀硫酸和碳酸氢钠反应生成二氧化碳,二氧化碳、水和硅酸钠反应生成难溶性硅酸,看到的现象是烧瓶中有气体生成、c中有沉淀生成,所以可以实现实验目的,故A正确;B.稀盐酸和二氧化锰不反应,浓盐酸和二氧化锰在加热条件下反应生成氯气,所以不能得到氯气,不能实现实验目的,故B错误;C.碳酸钠热稳定性较强,碳酸氢钠不稳定,受热易分解,所以d为碳酸钠、e为碳酸氢钠,故C错误;D.氯化铵不稳定受热易分解,所以该装置不能实现实验目的,故D错误;
考查方向
解题思路
A.强酸能弱酸盐反应生成弱酸,根据强酸制取弱酸判断酸性强弱;
B.稀盐酸和二氧化锰不反应,浓盐酸和二氧化锰在加热条件下反应生成氯气;
C.碳酸钠热稳定性较强,碳酸氢钠不稳定,受热易分解;
D.氯化铵不稳定受热易分解.
易错点
对反应装置即实验过程和实验结论认识不清
知识点
7.加热HCOONa固体,发生的反应有( )
HCOONa加热分解时,固体失重率与温度的关系如下图所示。下列说法正确的是( )
正确答案
解析
A.加热完全分解得到Na2C2O4时,失重率为2/136×100%≈1.47%<5%,则T<415℃时反应①、②同时发生,故B错误;B.由A中分析可知,反应①、②可能同时发生,故B错误;C.加热分解完全残留固体为Na2CO3,失重率为30/136×100%≈22.1%,则570℃<T<600℃时,残留固体的主要成分是Na2CO3,故C正确;D.残留固体中的m(Na2C2O4)=m(Na2CO3)时,无法判断所需时间,不能判断反应①、②的反应速率,故D错误.
考查方向
解题思路
加热分解完全残留固体为Na2CO3,失重率为30/136×100%≈22.1%,则570℃<T时残留固体的主要成分是Na2CO3,完全分解得到Na2C2O4时,失重率为2/136×100%≈1.47%,则T<415℃时反应①、②同时发生,残留固体中的m(Na2C2O4)=m(Na2CO3)时,无法判断所需时间,不能判断反应①、②的反应速率.
易错点
对图像的分析不到位
知识点
【科目】化学
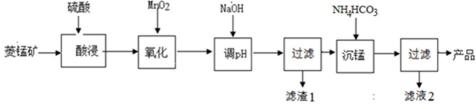
10. 以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品。(已知:Ksp(MnCO3) = 2.2×10−11,Ksp[Mn(OH)2] = 1.9×10−13,Ksp[Al(OH)3] = 1.3×10−33)
滤渣1中,含铁元素的物质主要是 (填化学式,下同);加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中 含量减少。
11.滤液2中,+1价阳离子除了H+外还有 (填离子符号)。
12.取“沉锰”前溶液a mL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8溶液,加热,Mn2+被氧化为MnO4−,反应一段时间后再煮沸5min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L−1 的(NH4)2Fe(SO4)标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液V mL。
① Mn2+与(NH4)2S2O8反应的还原产物为 (填化学式)。
② “沉锰”前溶液中c(Mn2+) = mol·L−1(列出表达式)。
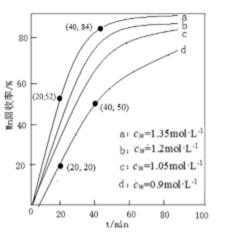
13.其他条件不变,“沉锰”过程中锰元素回收率与NH4HCO3初始浓度(c0)、反应时间的关系如下图所示。
NH4HCO3初始浓度越大,锰元素回收率越 (填“高”或“低”),简述原因 。
14. 若溶液中c(Mn2+) = 1.0 mol·L−1,加入等体积1.8 mol·L−1 NH4HCO3溶液进行反应,计算20 ~ 40 min内v(Mn2+) = 。
正确答案
(1)Fe(OH)3 Al(OH)3、SiO2
解析
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.滤渣1中,含铁元素的物质主要是Fe(OH)3;加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中SiO2、Al(OH)3溶解;故答案为:Fe(OH)3;SiO2、Al(OH)3;
考查方向
解题思路
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.滤渣1中,含铁元素的物质主要是氢氧化铁;加NaOH调节溶液的pH约为5,如果pH过大,可能导致滤渣1中氢氧化铝、二氧化硅溶解;
易错点
对公式记忆不清,不能熟练应用
正确答案
Na+、NH4+;
解析
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.滤液2中含有硫酸铵、硫酸钠等,+1价阳离子除了H+外还有:Na+、NH4+,故答案为:Na+、NH4+;
考查方向
解题思路
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.
易错点
对公式记忆不清,不能熟练应用
正确答案
① SO42− [或“H2SO4”“Na2SO4”“(NH4)2SO4”] ②
解析
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.①Mn2+被氧化,(NH4)2S2O8中S元素还原为SO42-,故答案为:SO42-;②由Mn元素守恒、电子转移守恒,可得关系式:Mn2+~MnO4-~5Fe2+,则n(Mn2+)=1/5n(Fe2+),所以c(Mn2+)=1/5×V×10−3L×bmol/L/a×10−3L=bV/5amol/L,故答案为:bV/5a
考查方向
解题思路
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.由Mn元素守恒、电子转移守恒,可得关系式:Mn2+~MnO4-~5Fe2+,结合关系式计算;
易错点
对公式记忆不清,不能熟练应用
正确答案
① 高 ② 根据Ksp=c(CO32−)·c(Mn2+),c(NH4HCO3)越大,c(CO32-)越大,c(Mn2+)越小,析出的MnCO3越多[或c(NH4HCO3)越大,c(CO32-)越大,使平衡MnCO3(s)
解析
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.①由图可知,NH4HCO3初始浓度越大,锰元素回收率越高;NH4HCO3初始浓度越大,溶液中c(CO32-)度越大,根据溶度积Ksp(MnCO3)=c(Mn2+)×c(CO32-)可知溶液c(Mn2+)越小,析出的MnCO3越多,故答案为:高;NH4HCO3初始浓度越大,溶液中c(CO32-)度越大,根据溶度积Ksp(MnCO3)=c(Mn2+)×c(CO32-)可知溶液c(Mn2+)越小,析出的MnCO3越多;
考查方向
解题思路
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.①由图可知,NH4HCO3初始浓度越大,锰元素回收率越高;NH4HCO3初始浓度越大,溶液中碳酸根离子浓度越大,根据溶度积可知溶液c(Mn2+)越小;
易错点
对公式记忆不清,不能熟练应用
正确答案
7.5×10−3 mol·L−1·min−1
解析
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.若溶液中c(Mn2+)=1.0 mol•L-1,加入等体积1.8 mol•L-1NH4HCO3溶液进行反应,混合后NH4HCO3溶液浓度为0.9mol/L,为图象中d曲线,20~40 min内△c(Mn2+)=1mol/L×1/2×(50%-20%)=0.15mol/L,则20~40 min内v(Mn2+)=0.15mol/L/(40−20)min=0.0075mol/(L.min),故答案为:0.0075mol/(L.min).
考查方向
解题思路
菱锰矿用稀硫酸溶解,MnCO3、FeCO3、Al2O3都和稀硫酸反应生成硫酸盐,SiO2不反应,酸性条件下,加入MnO2将Fe2+氧化为Fe3+,MnO2还原生成Mn2+,调节溶液的pH,使Fe3+、Al3+完全转化为Fe(OH)3、Al(OH)3沉淀,过滤分离,滤渣1为SiO2、Al(OH)3、Fe(OH)3,滤液中存在 MnSO4、硫酸钠等,加入碳酸氢铵得到MnCO3,过滤分离,滤液2中含有硫酸铵、硫酸钠等.若溶液中c(Mn2+)=1.0 mol•L-1,加入等体积1.8 mol•L-1NH4HCO3溶液进行反应,混合后NH4HCO3溶液浓度为0.9mol/L,为图象中d曲线,根据回收率可以计算△c(Mn2+),进而计算20~40 min内v(Mn2+).
易错点
对公式记忆不清,不能熟练应用
【科目】化学
15..乙二醛(OHC—CHO)是一种重要的精细化工产品。
Ⅰ. 工业生产乙二醛,乙醛(CH3CHO)液相硝酸氧化法在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,反应的化学方程式为 。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点是 。
16.乙二醇(HOCH2CH2OH)气相氧化法
① 已知:OHC—CHO(g) +2H2(g) 
2H2(g) + O2(g) 

乙二醇气相氧化反应HOCH2CH2OH(g) +O2(g) 

② 当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如下图所示。
反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是 、 。
17.Ⅱ. 乙二醛电解氧化制备乙醛酸(OHC—COOH)的生产装置如下图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸。
阴极反应式为 。
18.阳极液中盐酸的作用,除了产生氯气外,还有 。
19.保持电流强度为a A,电解t min,制得乙醛酸m g,列式表示该装置在本次电解中的电流效率η= 。
(设:法拉第常数为f C•mol−1;η=
正确答案
【答案】(1)3CH3CHO + 4HNO3 
解析
用乙醛制取乙二醛,方程式为3CH3CHO + 4HNO3 
对实验装置进行分析可知实验的缺点为尾气;
考查方向
解题思路
用乙醛制取乙二醛,方程式为3CH3CHO + 4HNO3 
对实验装置进行分析可知实验的缺点为尾气;根据计算公式计算化学平衡常数
根据电解池结构书写阴极反应式;盐酸作用除了产生氯气,应该还有增强导电性
易错点
电解制备乙醛酸的过程中对阳极阴极反应认识不清
正确答案
− 406 

解析
根据计算公式计算化学平衡常数
考查方向
解题思路
用乙醛制取乙二醛,方程式为3CH3CHO + 4HNO3 
对实验装置进行分析可知实验的缺点为尾气;根据计算公式计算化学平衡常数,根据电解池结构书写阴极反应式;盐酸作用除了产生氯气,应该还有增强导电性
易错点
电解制备乙醛酸的过程中对阳极阴极反应认识不清
正确答案
2H+ + 2e- = H2↑
解析
根据电解池结构书写阴极反应式;
考查方向
解题思路
用乙醛制取乙二醛,方程式为3CH3CHO + 4HNO3 
对实验装置进行分析可知实验的缺点为尾气;根据计算公式计算化学平衡常数
根据电解池结构书写阴极反应式;盐酸作用除了产生氯气,应该还有增强导电性
易错点
电解制备乙醛酸的过程中对阳极阴极反应认识不清
正确答案
增强导电性(或“平衡阴极区电解液电荷”等其他合理答案)
解析
盐酸作用除了产生氯气,应该还有增强导电性
考查方向
解题思路
用乙醛制取乙二醛,方程式为3CH3CHO + 4HNO3 
对实验装置进行分析可知实验的缺点为尾气;根据计算公式计算化学平衡常数
根据电解池结构书写阴极反应式;盐酸作用除了产生氯气,应该还有增强导电性
易错点
电解制备乙醛酸的过程中对阳极阴极反应认识不清
正确答案

解析

考查方向
解题思路
用乙醛制取乙二醛,方程式为3CH3CHO + 4HNO3 
对实验装置进行分析可知实验的缺点为尾气;根据计算公式计算化学平衡常数
根据电解池结构书写阴极反应式;盐酸作用除了产生氯气,应该还有增强导电性
易错点
电解制备乙醛酸的过程中对阳极阴极反应认识不清
【科目】化学
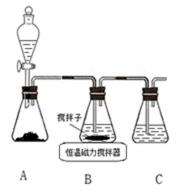
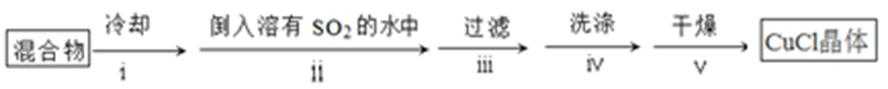
8. CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s) + 3HCl(aq) ⇌ H3CuCl4(aq)。
实验室用下图所示装置制取CuCl,反应原理为:
2Cu2+ + SO2 + 8Cl− + 2H2O == 2CuCl43− + SO42− + 4H+
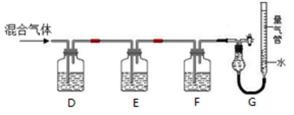
9.某同学利用如下图所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。
已知:i. CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O。
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
① D、F洗气瓶中宜盛放的试剂分别是 、 。
② 写出保险粉和KOH的混合溶液吸收O2的离子方程式: 。
正确答案
解析
:①A装置准备二氧化硫,B中盛放氯化铜溶液,与二氧化硫反应得到CuCl,C装置盛放氢氧化钠溶液,吸收未反应的二氧化硫,防止污染空气,故答案为:吸收SO2尾气;②操作ⅱ倒入溶有二氧化硫的溶液,有利于CuCl析出,二氧化硫具有还原性,可以防止CuCl被氧化;CuCl难溶于水、稀盐酸和乙醇,可以用水、稀盐酸或乙醇洗涤,减小因溶解导致的损失,故答案为:促进CuCl析出、防止CuCl被氧化;水、稀盐酸或乙醇;③由于CuCl见光分解、露置于潮湿空气中易被氧化,应避光、密封保存,故答案为:避光、密封;④提纯某混有铜粉的CuCl晶体实验方案:将固体溶于浓盐酸后过滤,去滤液加入大量的水稀释,过滤、洗涤、干燥得到CuCl,故答案为:将固体溶于浓盐酸后过滤,取滤液加入大量水,过滤,洗涤,干燥;
考查方向
解题思路
①A装置准备二氧化硫,B中盛放氯化铜溶液,与二氧化硫反应得到CuCl,C装置盛放氢氧化钠溶液,吸收未反应的二氧化硫,防止污染空气;②操作ⅱ倒入溶有二氧化硫的溶液,有利于CuCl析出,二氧化硫具有还原性,可以与溶液中氧气反应;CuCl难溶于水、稀盐酸和乙醇;③由于CuCl见光分解、露置于潮湿空气中易被氧化,应避光、密封;④利用浓盐酸溶解CuCl生成H3CuCl4,过滤分离,再用水稀释后过滤分离;
易错点
对实验方案,实验过程,实验原理认识不到位
正确答案
① NaOH溶液(或“KOH溶液”“Ba(OH)2溶液”等其他合理答案) CuCl的盐酸溶液
② 2S2O42−+3O2+4OH− == 4SO42−+2H2O
解析
: ①氢氧化钾会吸收二氧化碳,盐酸挥发出的HCl会影响氧气的吸收、二氧化碳的吸收,故D中盛放氢氧化钡溶液吸收二氧化碳,E中盛放保险粉(Na2S2O4)和KOH的混合溶液吸收氧气,F中盛放CuCl的盐酸溶液吸收CO,G测定氮气的体积,故答案为:氢氧化钡溶液;CuCl的盐酸溶液;②Na2S2O4在碱性条件下吸收氧气,发生氧化还原反应生成硫酸钠与水,反应离子方程式为:2S2O42-+3O2+4OH-=4SO42-+2H2O,故答案为:2S2O42-+3O2+4OH-=4SO42-+2H2O.
考查方向
解题思路
①氢氧化钾会吸收二氧化碳,盐酸挥发出的HCl会影响氧气的吸收、二氧化碳的吸收,故D中盛放氢氧化钡溶液吸收二氧化碳,E中盛放保险粉(Na2S2O4)和KOH的混合溶液吸收氧气,F中盛放CuCl的盐酸溶液吸收CO,G测定氮气的体积;②Na2S2O4在碱性条件下吸收氧气,发生氧化还原反应生成硫酸钠与水.
易错点
对实验方案,实验过程,实验原理认识不到位
【科目】化学
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如右下图所示。
20.基态Ti原子的价电子轨道表示式为 。
21.NaH的熔点为800℃,不溶于有机溶剂。NaH属于 晶体,其电子式为 。
22.AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为 (标明配位键)。
23.AlH4-中,Al的轨道杂化方式为 ;例举与AlH4-空间构型相同的两种离子 (填化学式)。
24.NaAlH4晶体中,与Na+紧邻且等距的AlH4-有 个;NaAlH4晶体的密度为 g·cm-3(用含a的代数式表示)。若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为 (填化学式)。
25.NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为 。
正确答案

解析
:Ti的原子序数为22,电子排布为1s22s22p63s23p63d24s2,价电子排布式为3d24s2,价电子轨道表示式为

考查方向
解题思路
Ti的原子序数为22,电子排布为1s22s22p63s23p63d24s2,价电子排布式为3d24s2,根据原子轨道中电子的填充规则画出其价电子轨道表示式;
易错点
核外电子分布图的书写,离子构型的书写
正确答案
离子 Na+[∶H]-
解析
NaH的熔点为800℃,不溶于有机溶剂,属于离子晶体;NaH是离子化合物,电子式为Na+[:H]-;
故答案为:离子;Na+[:H]-;
考查方向
解题思路
离子晶体的熔沸点较高,一般不溶于有机溶剂;NaH是离子化合物,其电子式由阴、阳离子的电子式组合而成;
易错点
核外电子分布图的书写,离子构型的书写
正确答案
解析
氯化铝中铝原子最外层电子只有3个电子,形成3个共价键,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供形成的配位键,如图

考查方向
解题思路
AlCl3在178℃时升华,其蒸气的相对分子质量约为267,则分子式为Al2Cl6,氯化铝中铝原子最外层电子只有3个电子,形成3个共价键,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供形成的配位键;
易错点
核外电子分布图的书写,离子构型的书写
正确答案
sp3 NH4+、BH4−(或“SO42−”“PO43−” 等其他合理答案)
解析
AlH4-中,Al的价层电子对数=4+1/2(3+1-1×4)=4,所以Al原子为sp3杂化;等电子体的结构相似,所以AlH4-空间构型相同的两种离子NH4+、BH4-(或“SO42-”“PO43-”);故答案为:sp3;NH4+、BH4-(或“SO42-”“PO43-”);
考查方向
解题思路
先求出中心原子的价层电子对数,再判断杂化类型;根据等电子体的结构相似;
易错点
核外电子分布图的书写,离子构型的书写
正确答案
8 

解析
: 以底面Na+离子研究,与之最近的AlH4-距离为√2/2anm,位于同一面的4个顶角以及其余4个侧面的面心上,共有8个;根据均摊法可知,晶胞中钠离子的个数为6×0.5+4×1/4=4,晶体的化学式为NaAlH4,所以晶胞中AlH4-的个数为4,该晶胞的质量为54×4/NAg,该晶胞体积为2a3nm3=2a3×10-21cm3,则该晶胞的密度为(216/NA)2a3×1021g•cm-3=108×1021/2a3NAg•cm-3;晶胞中AlH4-的个数为4,钠离子的个数为4,若NaAlH4晶胞底心处的Na+被Li+取代,则晶胞中AlH4-的个数为4,钠离子的个数为3,锂离子的个数为1,晶体的化学式为:Na3Li(AlH4)4;故答案为:8;
考查方向
解题思路
以底面Na+离子研究,与之最近的AlH4-位于同一面的4个顶角以及其余4个侧面的面心上;根据晶胞类型以及化学式计算出晶胞所含原子数,根据公式ρ=
易错点
核外电子分布图的书写,离子构型的书写
正确答案
3NaAlH4 == Na3AlH6 + 2Al + 3H2↑
解析
NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,即产物有Al、H2和AlH63-,方程式为:3NaAlH4═Na3AlH6+2Al+3H2↑;
故答案为:3NaAlH4═Na3AlH6+2Al+3H2↑.
考查方向
解题思路
根据NaAlH4的释氢机理得出产物,从而写出方程式.
易错点
核外电子分布图的书写,离子构型的书写