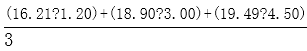- 真题试卷
- 模拟试卷
- 预测试卷
2.NA为阿伏伽德罗常数的值。下列说法正确的是( )
正确答案
解析
A.18gD2O中D的相对质量是2,D2O的相对质量是20。
B. 2 L 0.5 mol/L硫酸钾溶液中含1mol阴离子 ,但溶液中水微弱电离出OH-
C.0.1 mol丙烯酸中含有含碳氧双键和碳碳双键的数目为0.2NA。
D.3mol单质Fe完全转变为Fe3O4.(FeO. - Fe2O3.)1molFe生成二价铁,2molFe生成三价铁,共失去8NA个电子。
考查方向
解题思路
A.D的相对质量是2。
B. 溶液中水微弱电离出OH-
C.0.1 mol丙烯酸中含有含碳氧双键和碳碳双键。
D. Fe3O4.(FeO. - Fe2O3.)1molFe生成二价铁,2molFe生成三价铁
易错点
Fe3O4.(FeO. - Fe2O3.),丙烯酸中含有含碳氧双键和碳碳双键。
知识点
3.下列有关电解质溶液中粒子浓度关系正确的是 ( )
正确答案
解析
A、根据电荷守恒,pH=1的NaHSO4溶液存在:c(Na+)+c(H+)=2c(SO42‾)+c(OH‾),因为c(Na+)=c(SO42‾),所以c(H+)=c(SO42‾)+c(OH‾),正确;
B、含有AgCl和AgI固体的悬浊液:c(Ag+)> c(Cl‾)>c(Br‾),错误;
C、H2CO3的第一步电离大于第二步电离,所以c(H+) > c(HCO3‾) >c(CO32‾),但c(HCO3‾)不等于c(CO32‾),错误;
D、NaHC2O4和Na2C2O4物质的量相等,根据物料守恒可得:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],正确。
考查方向
解题思路
A、电荷守恒c(Na+)+c(H+)=2c(SO42‾)+c(OH‾)
B、c(Ag+)> c(Cl‾)>c(Br‾);
C、H2CO3的第一步电离大于第二步电离;
D、NaHC2O4和Na2C2O4物质的量相等。
易错点
H2CO3的第一步电离大于第二步电离,电解质溶液中的守恒定律。
知识点
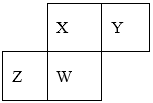
4.短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,.其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
正确答案
解析
A.同一周期的元素,原子序数越大,原子半径越小;不同周期的元素,原子核外电子层数越多,原子半径就越大。因此这四种元素的原子半径大小关系是:Z>W>X > Y,错误。
B.元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强。由于元素的非金属性:X>W>Z,所以它们的最高价氧化物对应水化物的酸性:X>W>Z,正确。
C.元素的非金属性越强,其相应的最简单的氢化物的稳定性就越强。由于元素的非金属性:Y>X>W>Z,所以元素的氢化物的稳定性:Y>X>W>Z,正确。
D.除非金属性很强的F、O元素外,一般情况下,元素原子的最外层电子数等于该元素原子的最外层电子数。X、Z、W的最高化合价分别与其主族序数相等,正确。
考查方向
解题思路
在短周期元素中,W原子的质子数是其最外层电子数的三倍,则W是15号的P元素,根据元素在周期表中的相对位置关系可确定:X是N元素,Y是O元素;Z是Si元素。
易错点
元素的推断。
知识点
5.对右图两种化合物的结构或性质描述错误的是( )
正确答案
解析
A. 醛基可以发生加成和苯环上发生取代反应
B. 醛基和C=C双键均能和酸性高锰酸钾溶液发生氧化还原反应
C.分子式不相同,右图比左图少2个H原子
D.既能用红外光谱区分,也可以用核磁共振氢谱区分
考查方向
解题思路
左图的有机物含有醛基和羟基;右图含有羧基,C=C双键。
易错点
官能团的性质。
知识点
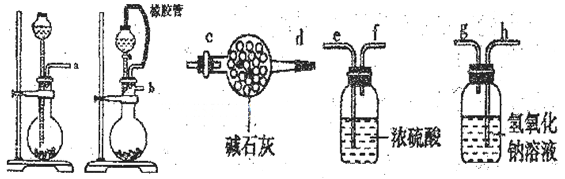
6.下列实验装置能达到相关实验目的的是( )
正确答案
解析
A.试剂瓶中为NaOH等碱性溶液时可与二氧化碳反应,而CO不反应,然后干燥可收集CO,且导气管均长进短出,装置合理,故A正确;
B.NaCl溶于水,与水分离选蒸发装置,不能利用坩埚加热,可选蒸发皿,故B错误;
C.NO的密度比空气小,不能排尽二氧化碳,NO不纯,应利用排水法收集,故C错误;
D.氢氧化铁胶体和硫酸钠溶液均可透过滤纸,应选渗析法分离,故D错误;
考查方向
解题思路
A.试剂瓶中为NaOH等碱性溶液时可与二氧化碳反应,而CO不反应,然后干燥可收集CO;
B.NaCl溶于水,与水分离选蒸发装置;
C.NO的密度比空气小,不能排尽二氧化碳,NO不纯;
D.氢氧化铁胶体和硫酸钠溶液均可透过滤纸.
易错点
NO的密度比空气小,不能排尽二氧化碳。
知识点
1.化学与人类生产、生活密切相关,下列说法正确的是( )
正确答案
解析
A.有机玻璃属于有机物并不属于硅酸盐
B.青蒿素含有氧元素不属于烃类物质
C.纯银器在空气中久置变黑是因为与氧气反应生成了氧化银
D.维生素C具有还原性,可以抑制硫酸亚铁被氧化
考查方向
解题思路
A.有机玻璃属于有机物
B.青蒿素含有氧元素
C. 纯银器在空气与氧气反应生成氧化银
D. 维生素C具有还原性做抗氧化剂
易错点
维生素C具有还原性做抗氧化剂。
知识点
7.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
正确答案
解析
用离子方程式判断若先和AlO2-:反应生成Al(OH)3,则与溶液中的OH-还是会反应生成AlO2-相当于先和OH-反应.若先和KOH反应,生成K2CO3,则CO32-会与Ba2+生成BaCO3沉淀,还是相当于先和Ba(OH)2反应.若先与BaCO3反应,溶解沉淀,溶液中还有K2CO3,还是会与Ba2+沉淀为BaCO3,所以先和K2CO3反应生成KHCO3后,再与BaCO3反应,沉淀溶解.所以,随CO2的通入,先生成BaCO3,再保持不变一段时间,然后又继续生成Al(OH)3沉淀,然后又保持不变一段时间,再沉淀逐渐溶解一部分,最后剩下的就是Al(OH)3
考查方向
解题思路
CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,第一步反应:CO2+Ba(OH)2=BaCO3↓+H2O,第二步反应:CO2+2KOH=K2CO3+H2O,第三步反应CO2+2KAlO2+3H2O=2Al(OH)3↓+K2CO3,第四步反应:K2CO3+CO2+H2O=2KHCO3,第五步反应:BaCO3+CO2+H2O=Ba(HCO3)2。所以图C正确,答案选C。
易错点
定量分析离子反应(用离子方程式判断若先和AlO2-)。
知识点
10.铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下:
(1)操作a的名称为 。
(2)在浸取过程中浓盐酸与Fe2O3的离子方程式 。
(3)写出加入30%H2O2过程中发生的离子反应方程式: 。
(4)加入Pb(NO3)2沉淀CrO42-时,检验沉淀是否完全的方法是: 。
(5)在废液中加入10%明矾溶液发生反应的离子方程式为 。
(6)由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,将含Cr2O72-的酸性废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+
①请分析电解过程中溶液pH不断上升的原因 。
②当电路中通过3mol电子时,理论上可还原
正确答案
(1)过滤
(2)Fe2O3+6H+=2Fe3++3H2O
(3)2CrO2—+ 3
(4)取上层清液,向其中再加入Pb(NO3)2溶液,若无沉淀产生,证明沉淀完全,否则未沉淀完全;
(5)SO42-+Pb2+=PbSO4↓;
(6)①电解时阴极消耗氢离子,亚铁离子还原Cr2O72-消耗氢离子,所以pH不断上升; ②0.25
解析
(1)将铬污泥粉碎可以增大与盐酸的接触面积,有利于提高浸取率;由流程图可知,操作a是把溶液与不溶物分离,应是过滤;
(2)在浸取过程中浓盐酸与Fe2O3的离子方程式Fe2O3+6H+=2Fe3++3H2O
(3)由流程图可知,加入30%H2O2的目的是在碱性条件下将CrO2-氧化为CrO42-,同时生成水,反应离子方程式为3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;故答案为:3H2O2+2CrO2-+2OH-=2CrO42-+4H2O;
(4)检验沉淀是否完全的方法是:静置分层后,取上层清液,继续滴加Pb(NO3)2溶液,无沉淀生成,说明沉淀完全;故答案为:静置分层后,取上层清液,继续滴加Pb(NO3)2溶液,无沉淀生成,说明沉淀完全;
(5)废液中含有Pb(NO3)2,废液中加入10%明矾溶液目的是将Pb2+转化为PbSO4沉淀,反应方程式为2Pb(NO3)2+KAl(SO4)2=2PbSO4↓+KNO3+Al(NO3)3;在废液中加入10%明矾溶液发生反应的离子方程式为SO42-+Pb2+=PbSO4↓
(6)①请分析电解过程中溶液pH不断上升的原因:电解时阴极消耗氢离子,亚铁离子还原Cr2O72-也消耗氢离子,所以pH不断上升;
②当电路中通过3mol电子时,理论上可还原
考查方向
本题主要考查了制备实验方案的设计;物质分离和提纯的方法和基本操作综合应用。
解题思路
(1)将铬污泥粉碎,可以增大反应物的接触面积,加快反应速率。二氧化硅不溶于盐酸,所以通过过滤进行分离。
(2)双氧水具有氧化性,能把CrO2—氧化生成CrO42—。
(3)如果沉淀不完全,则溶液中还含有CrO42—,继续滴加Pb(NO3)2溶液会继续生成沉淀,据此进行检验。
(4)明矾和硝酸铅反应生成硫酸铅沉淀。
易错点
离子的检验及(4)题中化学语言的正确运用,为易错点。
知识点
8.研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:
请回答下列问题:

(2)若反应 Ⅰ 在绝热密闭容器中进行,实验测得NO2( g )的转化率随时间变化的示意图如图所示, t3 ~t 4 时刻, NO2(g)的转化率 (NO2%)降低的原因是 。
(3)若反应 Ⅱ 在恒温、恒容条件下进行,下列能判断该反应一定达到平衡状态的是 。A. 容器内压强不再变化 B.n ( ClNO ) = n ( NO )C. 混合气体密度不变 D. υ 正 ( NO ) = υ 逆 ( ClNO )
(4)在一定温度和压强下,反应 Ⅱ 达到平衡,当 NO和 Cl 2 的比例不同时,对 Cl 2的转化率及平衡混合物中 ClNO 的体积分数都有影响。设 NO 和 Cl2 起始物质的量之比为 x ,平衡时 Cl2 的转化率为 a ,平衡混合物中 ClNO 的体积分数为y ,判断 a 、 x 、 y 三者的相互关系,用 a 和 x 的代数式表示 y ,y= 。
(5)实 验 室 可 用 NaOH 溶 液 吸 收 NO2 ,反 应 为2NO2 +2NaOH == NaNO3+NaNO2+H2O。含 0.2molNaOH 的水溶液与 0.2molNO2 恰好完全反应得1L溶液 A ,溶液B为 0.1mol· L-1 的CH 3 COONa 溶液,则两溶液中 c (NO3 - )、c ( NO2- )、c ( CH3COO- )由大到小的顺序 (已知 HNO 2 的电离常数 
正确答案
(1)K12/K2
(2)因反应为放热反应且反应容器为绝热容器,随着反应的进行,体系的温度会升高,故再次达平衡时的转化率会降低。
(3)AD
(4)y=2a/(x+1-a)
(5)c(NO3-)>c(NO2-)>c(CH3COO-); a、b、c
解析
(1)设已知的两个反应为①②,则4NO2(g)+2NaCl(s)
(2)若反应 Ⅰ 在绝热密闭容器中进行, 因反应为放热反应且反应容器为绝热容器,随着反应的进行,体系的温度会升高,故再次达平衡时的转化率会降低。实验测得NO2( g )的转化率随时间变化t3 ~t 4 时刻NO2( g )的转化率降低。
(3)若反应 Ⅱ 在恒温、恒容条件下进行, 容器内压强不再变化,υ 正 ( NO ) = υ 逆 ( ClNO )能判断该反应一定达到平衡状态。如果反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强增大,平衡正向进行,平衡时NO的转化率α2 增大;平衡常数随温度变化,不随浓度、压强变化,若要使K2减小,平衡逆向进行,反应是放热反应,依据平衡移动原理应升高温度,平衡逆向进行;n ( ClNO ) = n ( NO )无法证明同一物质的消耗速率等于生成速率。混合气体密度不变,p=m/v,由于质量是守恒的,恒容条件下进行反应;所以p不变,无法证明。
(4)在一定温度和压强下,反应 Ⅱ 达到平衡,当 NO和 Cl 2 的比例不同时,对 Cl 2的转化率及平衡混合物中 ClNO 的体积分数都有影响。设 NO 和 Cl2 起始物质的量之比为 x ,平衡时 Cl2 的转化率为 a ,平衡混合物中 ClNO 的体积分数为y ,判断 a 、 x 、 y 三者的相互关系,用 a 和 x 的代数式表示 y ,y= y=2a/(x+1-a)。
(5)实 验 室 可 用 NaOH 溶 液 吸 收 NO2 ,反 应 为2NO2 +2NaOH == NaNO3+NaNO2+H2O。含 0.2molNaOH 的水溶液与 0.2molNO2 恰好完全反应得1L溶液 A ,溶液B为 0.1mol· L-1 的CH 3 COONa 溶液,则两溶液中 c (NO3 - )、c ( NO2- )、c ( CH3COO- )由大到小的顺序c(NO3-)>c(NO2-)>c(CH3COO-);0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,反应为2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液A中NaNO3物质的量浓度为0.mol/L,NaNO2物质的量为0.1mol/L,溶液B为0.1mol?L-1的CH3COONa溶液,已知HNO2的电离常数Ka=7.1×10-4mol?L-1,CH3COOH的电离常数Ka=1.7×10-5mol?L-1,说明CH3COOH酸性小于HNO2的酸性,对应阴离子水解程度大,醋酸根离子和亚硝酸根离子水解,两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为:c(NO3-)>c(NO2-)>c(CH3COO-);
根据越弱越水解的规律,CH3COO‾水解程度大于NO2-的水解程度,所以离子浓度 由大到小的顺序为:c(NO3‾) > c(NO2-) > c(CH3COO‾);因为CH3COO‾水解程度大于NO2-的水解程度,所以溶液A的pH小于溶液B,向溶液A中加适量NaOH,溶液A的pH增大,向溶液B中加适量水,溶液B的pH减小,故b、c正确。
考查方向
解题思路
(1)设已知的两个反应为①②,则4NO2(g)+2NaCl(s)
(2)反应为放热反应且反应容器为绝热容器,随着反应的进行,体系的温度会升高。
(3)若反应 Ⅱ 在恒温、恒容条件下进行, 容器内压强不再变化。
(4) CH3COOH酸性小于HNO2的酸性,对应阴离子水解程度大,醋酸根离子和亚硝酸根离子水解,两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为:c(NO3-)>c(NO2-)>c(CH3COO-)
(5) 根据越弱越水解的规律,CH3COO‾水解程度大于NO2-的水解程度
易错点
化学反应速率和平衡图形分析。
知识点
9.碳酸氢铵、硫酸铵均是我国主要的氮肥品种,碳酸氢铵在贮存和运输过程中容易挥发损失。为了鉴定其质量和确定田间施用量,必须测定其含氮量。
I.某学生欲测定碳酸氢铵化肥中的含氮量,选用下列装置通过测定生成二氧化碳的量间接测出化肥的含氮量。
(1)请选择必要的装置(每个装置最多使用一次),按气流方向连接顺序为__________ 组装好装置,连在最后的装置起到的作用 。
(2) 检验气密性后,将样品放入圆底烧瓶中,滴加液体。该液体最适合的是_________________.
A.稀盐酸
B.稀硫酸
C.浓硝酸
D.氢氧化纳
II.如果氮肥中成分是硫酸铵,则可以用甲醛法测定含氮量,反应为:2(NH4)2SO4+6HCHO=(CH2)6N4+2H2SO4再将生成的酸用氢氧化钠标准溶液滴定,从而测出氮的含量。步骤如下:
(3)用差量法称取固体(NH4)2SO4样品0.6g于烧杯中,加蒸馏水溶解配成100mL溶液,准确量取20.00mL的待测液溶液于锥形瓶中,加入适量l8%的中性甲醛,放置5min后,加入1-2滴_______指示剂(已知滴定终点的pH约为8.8),用浓度为0.0800mol/L氢氧化钠标准溶液滴定至终点。再重复滴定2次,三次滴定的读数如下表:
计算出该样品中的氮的质量分数为_______________。
(4)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,则此实验测定的含氮量比实际值________(填”偏大“偏小”或“无影响”)。
(5)如果测定碳酸氢铵化肥中的含氮量时,也使用甲醛法是否合理____________(填“是”或“否”),理由是 。
正确答案
(1)b-e-f-h-g-c
防止空气中的水蒸气和CO2进入前面装置影响实验结果
(2)B
(3)酚酞 14%
(4)偏小
(5) 否,因为用甲醛法制的碳酸不稳定,不适合中和滴定
解析
(1)根据反应装置--干燥装置--吸收装置-尾气处理装置排序,所以其排列顺序是:b-e,f-h,g-c,故答案为:b-e,f-h,g-c;
(2)制取二氧化碳时需要碳酸盐和酸反应,稀盐酸、浓硝酸都具有挥发性,影响实验结果,氢氧化钠和盐不能生成二氧化碳,故选B;
(3)硫酸铵属于强酸弱碱盐,其溶液呈酸性,所以需要酸式滴定管量取硫酸铵溶液,滴定终点的pH约为8.8,酚酞的变色范围是8-10,所以选取酚酞作指示剂;滴定终点时,溶液从无色变为浅红色,30s内不褪色;
2(NH4)2SO4+6HCHO=(CH2)6N4+2H2SO4+6H2O、2NaOH+H2SO4=Na2SO4+2H2O,所以硫酸铵和NaOH的关系式为:(NH4)2SO4---2NaOH,NaOH溶液的平均体积=
mL=15.3mL,根据(NH4)2SO4---2NaOH得m[(NH4)2SO4]=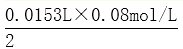
(4)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,导致NaOH溶液的量偏小,根据(NH4)2SO4---2NaOH得,导致测定N含量偏小;
(5)因为氢氧化钠和碳酸氢根离子反应生成氢氧化钠反应,所以会导致测量结果偏大,故答案为:否;用氢氧化钠标准溶液滴定时,溶液中HCO3-中的H+也会和氢氧化钠中和.
考查方向
解题思路
(1)本题考查实验装置的选择和连接,实验装置的连接顺序为发生装置、净化装置、干燥装置、性质或收集装置、尾气处理装置。一般除杂在前,干燥在后;若是燃烧管除杂,则干燥在前;若用洗气瓶,则“长进短出”,若用干燥管,则“大进小出”;根据题意知,装有氢氧化钠溶液的洗气瓶为二氧化碳的吸收装置,为保证实验结果准确,必须防止水蒸气和外界空气的干扰;为保证分液漏斗内液体顺利流下,应选第二个装置作为二氧化碳的发生装置;根据上述分析连接次序为:b-e,f-h,g-c;
(2)盐酸和硝酸易挥发,会干扰二氧化碳的测定,氢氧化钠溶液与样品反应不会生成二氧化碳,所以分液漏斗内的液体应为稀硫酸,选B;
(3)(NH4)2SO4属于强酸弱碱盐,水解显酸性,所以用酸式滴定管准确取出20.00mL的溶液;滴定终点的pH约为8.8,酚酞变色范围为8.2——10,应用酚酞作指示剂;用浓度为0.08mol/L氢氧化钠标准溶液滴定,达滴定终点时的现象为溶液从无色变为浅红色 ,且30s内不褪色;分析题给数据知,第二组数据误差较大,应舍弃,所用氢氧化钠溶液的体积为15.00mL 根据题给反应得氮原子与氢氧化钠之间的关系式:N——NaOH,代入数据计算可得,0.6g样品中含氮原子的物质的量为0.08mol/L×0.015L×5=0.006mol,其质量为0.084g,质量分数为14%;
(4)在滴定实验结束后发现滴定用的碱式滴定管玻璃尖嘴内出现了气泡,滴定开始时无气泡,代入计算得氢氧化钠溶液的体积偏小,则此实验测定的含氮量比实际值偏小;
(5).如果测定碳酸氢铵中的含氮量时,使用甲醛法不合理,理由是因为用氢氧化钠标准溶液滴定时,溶液中HCO3—中的H+也会和氢氧化钠中和。
易错点
(1)一般除杂在前,干燥在后;若是燃烧管除杂,则干燥在前;若用洗气瓶,则“长进短出”,若用干燥管,则“大进小出”;
(2)盐酸和硝酸易挥发,会干扰二氧化碳的测定
知识点
11.【化学-选修2:化学与技术】
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一。水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景。人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法。
(1)天然水在净化处理过程中加入明矾做混凝剂,其净水作用的原理是_________(用离子方程式表示)
(2)家庭用水可以用肥皂水检验其硬度,因为 。家用净水器中装有活性炭和阳离子交换树脂(NaR),用过的阳离子交换树脂放入 中可再生。
(3)电渗析法淡化海水的示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
阳极的主要电极反应式是________。在阴极附近加入无色酚酞,看到的现象是___________________________。淡水的出口为________(填“a”“b”或“c”)。
(4)利用海水制得的食盐,制取纯碱的简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①滤出晶体C后,从滤液D中提取氯化铵有两种方法:
方法一、通入氨,冷却、加食盐,过滤;
方法二、不通氨,冷却、加食盐,过滤。
对两种方法的评价正确的是(选填编号)_____________。
a.方法一析出的氯化铵纯度更高
b.方法二析出的氯化铵纯度更高
c.方法一的滤液可直接循环使用
d.方法二的滤液可直接循环使用
②提取的NH4Cl中含有少量Fe2+、SO42―。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。加热至沸的目的是___________。滤渣的主要成分是_______________、____________________。
正确答案
(1)Al3++3H2O
(2)硬脂酸钠与硬水中的钙离子、镁离子形成硬脂酸钙、硬脂酸镁沉淀 食盐水
(3)2Cl--2e-===Cl2↑ 阴极附近溶液变红色,有无色气体放出 b
(4)① a d ② 使Fe3+完全水解为Fe(OH)3
Fe(OH)3 BaSO4
解析
(1)混凝剂是吸附水中的微小悬浮颗粒,凝聚成较大的颗粒,而快速沉降的主要作用,要具备水解生成胶体的性质,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,如明矾,铝离子水解生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性,所以能净水,水解方程式为Al3++3H2O⇌Al(OH)3+3H+;
(2)肥皂中含有高级酯肪酸钠,能与硬水中的钙离子、镁离子形成硬脂酸钙、硬脂酸镁沉淀;用过的阳离子交换树脂中钠离子被钙、镁离子交换掉了,要再生可以放在食盐中,将钙镁离子再换成钠离子, 故答案为:高级酯肪酸钠能与硬水中的钙离子、镁离子形成硬脂酸钙、硬脂酸镁沉淀;食盐水;
(3)依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过,所以阳极上是阴离子失电子发生氧化反应,海水中的氯离子失电子生成氯气,电极反应为:2Cl--2e- =Cl2↑,阴极是氢离子得到电子发生还原反应生成氢气,阴极附近氢氧根离子浓度增大,在阴极附近加入无色酚酞,可以看到阴极附近溶液变红色,有无色气体放出;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出;阴极附近溶液变红色,有无色气体放出;b;
(4)①滤液D中含有碳酸氢钠和氯化铵,a.方法一通入氨,使溶液中的碳酸氢钠生成碳酸钠,再加食盐,过滤,析出的氯化铵纯度更高,故a正确; b.方法二没有通氨气,冷却、加食盐,过滤,析出的氯化铵中会有碳酸氢钠,纯度不高,故b错误; c.方法一的滤液含有碳酸钠不可直接循环使用,故c错误; d.方法二的滤液主要成分还是碳酸氢钠和氯化铵,还有氯化钠,可直接循环使用,故d正确; 故选ad;
②提取的NH4Cl中含有少量Fe2+、SO42-.将产品溶解,加入H2O2,将亚铁离子氧化成铁离子,加热至沸,促使铁离子水解生成氢氧化铁沉淀,再加入BaCl2溶液,使硫酸根离子沉淀,过滤,蒸发结晶,得到工业氯化铵。
考查方向
解题思路
(1)混凝剂是溶液中水解生成胶体的盐类,净水作用是吸附悬浮杂质使其聚沉达到净化目的;明矾可水解生成具有吸附性的胶体;
(2)肥皂中含有高级酯肪酸钠,能与钙离子生成沉淀;用过的阳离子交换树脂中钠离子被钙、镁离子交换掉了,要再生可以放在食盐中,将钙镁离子再换成钠离子;
(3)依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过.所以阳极上是阴离子失电子发生氧化反应,海水中的氯离子失电子生成氯气;阴极是氢离子得到电子发生还原反应生成氢气,阴极附近氢氧根离子浓度增大;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出;
(4)①滤液D中含有碳酸氢钠和氯化铵,a.方法一通入氨,使溶液中的碳酸氢钠生成碳酸钠,再加食盐,过滤,析出的氯化铵纯度更高; b.方法二没有通氨气,冷却、加食盐,过滤,析出的氯化铵中会有碳酸氢钠,纯度不高; c.方法一的滤液含有碳酸钠不可直接循环使用; d.方法二的滤液主要成分还是碳酸氢钠和氯化铵,还有氯化钠,可直接循环使用;
②提取的NH4Cl中含有少量Fe2+、SO42-.将产品溶解,加入H2O2,将亚铁离子氧化成铁离子,加热至沸,促使铁离子水解生成氢氧化铁沉淀,再加入BaCl2溶液,使硫酸根离子沉淀,过滤,蒸发结晶,得到工业氯化铵,据此答题。
易错点
依据电渗析法淡化海水示意图分析,阳极上是阴离子失电子发生氧化反应;阴极是氢离子得到电子发生还原反应生成氢气;在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出。