- 常见阴离子的检验
- 共41题
“酸化”是实验中经常采用的方法,下列说法正确的是
正确答案
解析
略
知识点
下列实验方案不能达到预期目的的是
正确答案
解析
略
知识点
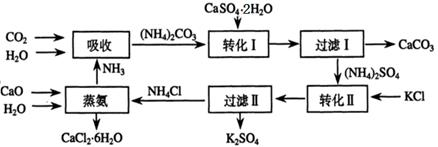
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要_________等原料。
(2)石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式为_________。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有_________(填化学式)等物质,该固体可用作生产水泥的原料。
(4)检验过滤Ⅰ所得滤液中含有CO32-的方法是_________。
(5)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是_________。
a. 熔点较低(29℃熔化)
b. 能导电
c. 能制冷
d. 无毒
(6)上述工艺流程中体现绿色化学理念的是_________。
正确答案
(1)CaCO3 NH3 H2O
(2)CaSO4+CO32-=CaCO3+SO42-
(3)CaSO4
(4)滤液中滴加盐酸产生气泡
(5)ad
(6)碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中)
解析
略。
知识点
下列实验能达到预期目的的是
正确答案
解析
略
知识点
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,
溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
正确答案
解析
略
知识点
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是
正确答案
解析
略
知识点
工业上从电解精炼铜的阳极泥(含金、银、铜、硒等单质)中提取硒的湿法工艺流程如下:
(1)向溶液X中加入铁屑的作用是________,此操作中不能加入过量铁粉的原因是________。
(2)检验溶液Z中阴离子的操作方法是________。
(3)过滤操作中要用到玻璃棒,请另举两例用到玻璃棒的实验或操作:________。
(4)实验室

(5)粗硒中硒的含量可用如下方法测定:

正确答案
(1)将SeO42-还原为SeO32-;过量铁粉会将Cu2+、SeO32-均还原为单质,不利于硒的分离
(2)取溶液X少许置于试管中,滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42-
(3)粗盐提纯、一定物质的量浓度溶液的配制、物质的溶解、溶液的蒸发、浓硫酸的稀释等(只要正确合理即给分)
(4)较浓的硫酸;SO2易溶于水,用较浓的硫酸有利于 SO2的逸出;b
(5)锥形瓶、碱式滴定管;90.85%
解析
略。
知识点
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1mol/L(此数值忽略水的电离及离子的水解)。
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是 。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是 。
(3)甲同学最终确定原溶液中所含阳离子有 ,阴离子有 ;并据此推测原溶液应该呈 性,原因是 (请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为
。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为 g。
正确答案
(1)
(2)
(3)Mg2+、Al3+;
(4)
解析
略
知识点
某溶液可能含有Na+ 、Ag+、Al3+、S2-、CO32-、SO32-、NO3-等离子中的数种。向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色为黄色。根据以上实验现象,下列关于原溶液中离子成分的推测正确的是()
正确答案
解析
略
知识点
某溶液中含有NO3-、S2-、AlO2-、SO32-四种阴离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的NaOH溶液,则溶液中物质的量基本不变的阴离子是()
正确答案
解析
略
知识点
扫码查看完整答案与解析