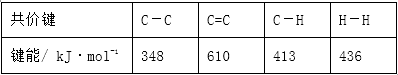- 有关反应热的计算
- 共34题
26.TiO2在工业生产和日常生活中有重要用途。
I.工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:( )(填“需要”或“不需要”)。
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。
答:( )。
II.TiO2可通过下述两种方法制备金属钛:
“方法一”是电解TiO2来获得Ti(同时产生O2):将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为___________________________________。
(4)电解过程中需定期向电解槽池中加入碳块的原因是______________________。
“方法二”是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:
TiO2 (s)+2Cl2 (g)
所以不能直接由 TiO2 和 Cl2 反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(5)已知:C(s)+O2 (g) = CO2 (g) ΔH=-394 kJ·mol-1。请填空:
TiO2 (s)+C (s)+2Cl2 (g) = TiCl4 (l)+CO2 (g) ΔH= ______________
(6)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:____________________________________________。
正确答案
(1)不需要
(2)Al2O3+2NaOH=2NaAlO2+H2O ; SiO2+2NaOH=Na2SiO3+H2O
(3)TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti)
(4)碳单质会与阳极产生的氧气反应而不断减少
(5)-243 kJ·mol-1
(6)碳单质与氧气反应减小产物浓度使平衡向右移动,导致反应顺利进行
解析
解析已在路上飞奔,马上就到!
知识点
9. 已知:
现有18 g液态H2O,蒸发时吸收的热量为()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.氨基甲酸钱是一种用途广泛的化工原料。有关它的资料如下:
①常温下,在干燥的空气中稳定,遇水或潮湿空气则生成碳酸钱或碳酸氢铵;
②熔点580C,590C则可分解成NH3和CO2气体;
③在密封管内加热至1200C一1400C时失水生成尿素[CO(NH2)2];
④酸性溶液中迅速分解;
⑤合成氨基甲酸铵原理为:
(1)仪器B名称________;盛放药品是: ________;
(2)写出氨基甲酸铵在密封管内加热至1200C— 1400C生成尿素的反应方程式:________________________
(3)合成氨基甲酸铵的反应在一定条件下能自发进行,该反应的反应热ΔH_____O(填“)”“=”或“<”)
(4)有同学建议该CO2发生装置直接改用“干冰”,你认为他的改进有何优点:(回答二点)
①________________;②________________
(5)该实验装置中有明显导致实验失败的隐患有:(指出主要二处)
①________________;②________________
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析