- 燃烧热
- 共16题
下列说法不正确的是
正确答案
解析
略
知识点
25.(1)一定温度下,向某容积固定的密闭容器中加入适量(NH4)2S固体,发生如下反应:
① (NH4)2S(s) 
② H2S(g) 
达到平衡时测得H2S和H2物质的量浓度分别为4 mol·L-1和1mol·L-1。则反应①的化学平衡常数K= 。
(2)25℃时,向20 mL 0.1mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,当NaOH溶液分别加到:①10 mL、②20 mL、③c (Na+)=c (CH3COO-)、④40 mL时,下列说法正确的是 。(填序号)
A.①中溶液显酸性,则c(Na+)>c(CH3COOH)
B.②中存在c (CH3COOH)+ c (CH3COO-)=0.05mol·L-1
C.③中混合溶液体积大于40 mL
D.④中水电离出的c(H+)最大
(3)密闭容器中发生下列反应:A(g)+B(g) 
(4)已知1.6 g液态甲醇在室温时完全燃烧放出的热量为68.4 kJ,则该条件下甲醇燃烧的热化学方程式为 。
若将甲醇的燃烧反应设计成原电池装置,能量的利用率会更高,当电解质溶液为酸性时,该电池负极的电极反应式为 。
(5)室温时,Ksp(CaCO3)=4.96×10-9,Ksp(MgCO3)=6.82×10-6。含有MgCO3沉淀的MgCl2溶液中,已知c(Mg2+)=0.2 mol · L-1,如果加入等体积的CaCl2溶液,若要产生CaCO3沉淀,加入CaCl2溶液的物质的量浓度最小约为 。
正确答案
(1)400
(2)AB
(3)
(4)2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H= -2736kJ·mol-1
CH3OH-6e-+H2O=CO2+6H+
(5)1.45×10-4mol · L-1
解析
略
知识点
下面均是正丁烷与氧气反应的热化学方程式(25°,101kPa):
①C4H10(g)+
②C4H10(g)+ 
③C4H10(g)+ 
④C4H10(g)+ 
由此判断,正丁烷的燃烧热是
正确答案
解析
略
知识点
下列说法正确的是
正确答案
解析
A选项:题给化合物正确的名称为2,2,4,5-四甲基-3,3-二乙基己烷。B选项:苯甲酸的分子式为C7H6O2,可将分子式变形为C6H6·CO2,因此等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等。C选项:苯不能使酸性高锰酸钾溶液褪色。
知识点
脱水偶联反应是一种新型的直接烷基化反应,例如:
(1) 化合物Ⅰ的分子式为_____,1mol该物质完全燃烧最少需要消耗_____molO2.
(2) 化合物Ⅱ可使____溶液(限写一种)褪色;化合物Ⅲ(分子式为C10H11C1)可与NaOH水溶液共热生成化合物Ⅱ,相应的化学方程式为______.
(3) 化合物Ⅲ与NaOH乙醇溶液工热生成化合物Ⅳ,Ⅳ的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为为1:1:1:2,Ⅳ的结构简式为_______.
(4) 由CH3COOCH2CH3可合成化合物Ⅰ.化合物Ⅴ是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物Ⅵ. Ⅴ的结构简式为______,Ⅵ的结构简式为______.
(5) 一定条件下,

正确答案
见解析
解析
⑴C6H10O3 7
⑵ 溴水或酸性高锰酸钾 从条件可知是卤化物的水解反应,化合物Ⅲ为


⑷化合物Ⅴ无支链,碳链两端呈对称结构。所以Ⅴ的结构简式为

⑸
知识点
下列各组混合物,其总的物质的量均为a mol,组内各物质的物质的量以任意比混合,完全燃烧时消耗O2的量不变的是 ( )
正确答案
解析
略
知识点
下表中列出了25℃、101kPa时一些物质的燃烧热数据
已知键能:C—H键:413.4 kJ·mol﹣1、H—H键:436.0 kJ·mol﹣1。则下列叙述正确的是
正确答案
解析
略
知识点
一些烷烃的燃烧热( kJ/mol)如下:
下列推断正确的是
正确答案
解析
略
知识点
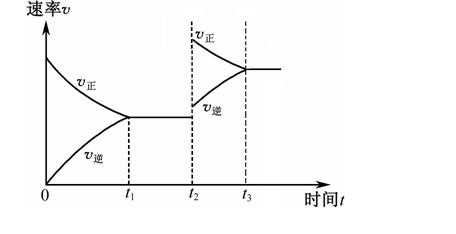
13.关于下列各图的叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12. 关于下列各图的叙述正确的是()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析