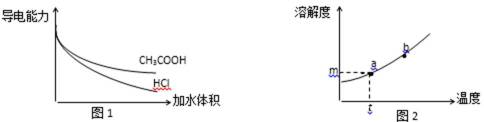- 水泥的主要化学成分、生产原料及其用途
- 共9题
亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。某化学兴趣小组对食盐与亚硝酸钠进行多角度探究:
(一)鉴别NaCl和NaNO2
(二)该小组用如下装置(略去夹持仪器)制备亚硝酸钠
已知:
①2NO+Na2O2=2NaNO2;
②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
8.甲同学用沉淀分析法
经查:常温下Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10。分别向盛有5mL0.0001mol·L-1两种盐溶液的试管中同时逐滴滴加0.0001mol·L-1硝酸银溶液,先生成沉淀的是装有 ▲ 溶液的试管。
9.乙同学测定溶液pH
用pH试纸分别测定0.1mol·L-1两种盐溶液的pH,测得NaNO2溶液呈碱性。该溶液呈碱性的原因是 ▲ (用离子方程式解释)。
10.使用铜丝的优点是 ▲ 。
11.装置A中发生反应的化学方程式为 ▲ 。装置C中盛放的药品是 ▲ ;(填字母代号)A浓硫酸 BNaOH溶液 C水 D四氯化碳仪器F的作用 ▲ 。
12.该小组称取5.000g制取的样品溶于水配成250.0mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
①第一次实验数据出现异常,造成这种异常的原因可能是 ▲ (填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为 ▲ 。
③该样品中亚硝酸钠的质量分数为 ▲ 。
正确答案
NaCl
解析
鉴别NaCl和NaNO2,常温下Ksp(AgNO2)=2×10-8>Ksp(AgCl)=1.8×10-10。分别向盛有5mL0.0001mol·L-1两种盐溶液的试管中同时逐滴滴加0.0001mol·L-1硝酸银溶液,根据溶度积大的向小的转化,所以最开始形成的沉淀是AgCl,则该溶液是NaCl溶液。 NaNO2溶液呈碱性由于发生了水解产生了OH-,该溶液呈碱性的原因是NO2-+H2O 
考查方向
解题思路
要明确,溶度积大的可以向溶度积小的方向转化,盐溶液呈酸或呈碱是由于发生了水解导致的;在此流程图中,A的作用是制取NO2,C的作用是制取NO,D的作用是除去水,因为后面有Na2O2会和水发生化学反应,会影响实验结果,E的作用是让NO与Na2O2发生反应产生NaNO2,F的作用是防止水蒸气的进入影响实验结果,这和D的作用相似,G的作用也较明显,放到流程图的最后的、有制取具有污染性气体的都会在最后除去污染性的物质,所以G的作用在于除去有污染性的气体。在酸碱滴定过程中,引起某组实验结果和其他的实验数据相差很大,就要考虑误差,引起这种误差的在3个选项中也很容易选,而对于最后的方程式则需要借助氧化还原反应中的的是电子守恒来写并且配平,最后一步要根据题目中所给的数据信息对数据按要求计算即可。
易错点
对溶度积的概念理解有误,不明白盐类水解的原因,没有看明白在实验流程过程中的各个环节的目的是怎样的,不能正确写出化学反应方程式和离子方程式,在滴定过程中的误差分析以及数据处理都会带来一定的失误,
正确答案
NO2-+H2O 
解析
鉴别NaCl和NaNO2,常温下Ksp(AgNO2)=2×10-8>Ksp(AgCl)=1.8×10-10。分别向盛有5mL0.0001mol·L-1两种盐溶液的试管中同时逐滴滴加0.0001mol·L-1硝酸银溶液,根据溶度积大的向小的转化,所以最开始形成的沉淀是AgCl,则该溶液是NaCl溶液。 NaNO2溶液呈碱性由于发生了水解产生了OH-,该溶液呈碱性的原因是NO2-+H2O 
考查方向
解题思路
要明确,溶度积大的可以向溶度积小的方向转化,盐溶液呈酸或呈碱是由于发生了水解导致的;在此流程图中,A的作用是制取NO2,C的作用是制取NO,D的作用是除去水,因为后面有Na2O2会和水发生化学反应,会影响实验结果,E的作用是让NO与Na2O2发生反应产生NaNO2,F的作用是防止水蒸气的进入影响实验结果,这和D的作用相似,G的作用也较明显,放到流程图的最后的、有制取具有污染性气体的都会在最后除去污染性的物质,所以G的作用在于除去有污染性的气体。在酸碱滴定过程中,引起某组实验结果和其他的实验数据相差很大,就要考虑误差,引起这种误差的在3个选项中也很容易选,而对于最后的方程式则需要借助氧化还原反应中的的是电子守恒来写并且配平,最后一步要根据题目中所给的数据信息对数据按要求计算即可。
易错点
对溶度积的概念理解有误,不明白盐类水解的原因,没有看明白在实验流程过程中的各个环节的目的是怎样的,不能正确写出化学反应方程式和离子方程式,在滴定过程中的误差分析以及数据处理都会带来一定的失误,
正确答案
可以控制反应的发生与停止
解析
浓HNO3和Cu会产生NO2,而试管中加入的是铜丝,而且铜丝伸出试管外,即铜丝可以伸入浓HNO3中,也可以抽出来,所以此处的铜丝的好处在于控制反应的发生与停止。
考查方向
解题思路
要明确,溶度积大的可以向溶度积小的方向转化,盐溶液呈酸或呈碱是由于发生了水解导致的;在此流程图中,A的作用是制取NO2,C的作用是制取NO,D的作用是除去水,因为后面有Na2O2会和水发生化学反应,会影响实验结果,E的作用是让NO与Na2O2发生反应产生NaNO2,F的作用是防止水蒸气的进入影响实验结果,这和D的作用相似,G的作用也较明显,放到流程图的最后的、有制取具有污染性气体的都会在最后除去污染性的物质,所以G的作用在于除去有污染性的气体。在酸碱滴定过程中,引起某组实验结果和其他的实验数据相差很大,就要考虑误差,引起这种误差的在3个选项中也很容易选,而对于最后的方程式则需要借助氧化还原反应中的的是电子守恒来写并且配平,最后一步要根据题目中所给的数据信息对数据按要求计算即可。
易错点
对溶度积的概念理解有误,不明白盐类水解的原因,没有看明白在实验流程过程中的各个环节的目的是怎样的,不能正确写出化学反应方程式和离子方程式,在滴定过程中的误差分析以及数据处理都会带来一定的失误,
正确答案
Cu +4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O C防止水蒸气进入
解析
Cu与浓HNO3反应会产生NO2,所以化学反应方程式是:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。 题目中要求的是制取NaNO2,但试管中产生的是NO2,题目中所给的已知条件中是NO和Na2O2反应来制取的NaNO2,所以在C中盛放的物质必须要将NO2转化为NO,在四个选项中,只有水可以,化学反应方程式为:3NO2+H2O=2HNO3+NO,其中A、B、D都不能将NO2转化为NO,所以此处选C。 F处装的是碱石灰,碱石灰可以起到吸水干燥的作用,所以F的作用是防止水蒸气进入影响实验结果。
考查方向
解题思路
要明确,溶度积大的可以向溶度积小的方向转化,盐溶液呈酸或呈碱是由于发生了水解导致的;在此流程图中,A的作用是制取NO2,C的作用是制取NO,D的作用是除去水,因为后面有Na2O2会和水发生化学反应,会影响实验结果,E的作用是让NO与Na2O2发生反应产生NaNO2,F的作用是防止水蒸气的进入影响实验结果,这和D的作用相似,G的作用也较明显,放到流程图的最后的、有制取具有污染性气体的都会在最后除去污染性的物质,所以G的作用在于除去有污染性的气体。在酸碱滴定过程中,引起某组实验结果和其他的实验数据相差很大,就要考虑误差,引起这种误差的在3个选项中也很容易选,而对于最后的方程式则需要借助氧化还原反应中的的是电子守恒来写并且配平,最后一步要根据题目中所给的数据信息对数据按要求计算即可。
易错点
对溶度积的概念理解有误,不明白盐类水解的原因,没有看明白在实验流程过程中的各个环节的目的是怎样的,不能正确写出化学反应方程式和离子方程式,在滴定过程中的误差分析以及数据处理都会带来一定的失误,
正确答案
①bc②6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O③69%
解析
①第一次实验数据出现异常,造成这种异常的原因可能是由于酸式滴定管用蒸馏水洗净后未用标准液润洗或者滴定终点时仰视读数,而锥形瓶洗净后未干燥对实验结果没有影响,所以此处选b、c; ②高锰酸钾中Mn处于最高价态,做氧化剂,反应后化合价降低,则NaNO2中N的化合价升高,做还原剂,则离子方程式为6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O ③根据化学反应方程式中的系数比计算出NaNO2的质量,再除以称取的质量就可以算出答案;设滴定时消耗的NaNO2的物质的量为x
2KMnO4--------5NaNO2
2 5
x 0.1000mol/L×(19.88+20.00+20.12) /3
计算出x=0.005mol,该样品中亚硝酸钠的质量分数为[(69×0.005×10)÷5 ] ×100%=69%
考查方向
解题思路
要明确,溶度积大的可以向溶度积小的方向转化,盐溶液呈酸或呈碱是由于发生了水解导致的;在此流程图中,A的作用是制取NO2,C的作用是制取NO,D的作用是除去水,因为后面有Na2O2会和水发生化学反应,会影响实验结果,E的作用是让NO与Na2O2发生反应产生NaNO2,F的作用是防止水蒸气的进入影响实验结果,这和D的作用相似,G的作用也较明显,放到流程图的最后的、有制取具有污染性气体的都会在最后除去污染性的物质,所以G的作用在于除去有污染性的气体。在酸碱滴定过程中,引起某组实验结果和其他的实验数据相差很大,就要考虑误差,引起这种误差的在3个选项中也很容易选,而对于最后的方程式则需要借助氧化还原反应中的的是电子守恒来写并且配平,最后一步要根据题目中所给的数据信息对数据按要求计算即可。
易错点
:对溶度积的概念理解有误,不明白盐类水解的原因,没有看明白在实验流程过程中的各个环节的目的是怎样的,不能正确写出化学反应方程式和离子方程式,在滴定过程中的误差分析以及数据处理都会带来一定的失误,
7.下列说法不正确的是
正确答案
解析

B选项吸热反应主要有大部分分解反应,氢氧化钡晶体和氯化铵固体反应、C + H2O==CO + H2 。而铝热反应即高温下铝与氧化铁反应是放热反应,错误
C选项刚玉、红宝石主要成分是氧化铝,陶瓷、分子筛主要成分是硅酸盐,正确
D选项分散质粒子直径在1nm~100nm之间的分散系属于胶体,纳米材料的制备,冶金工业中的选矿,石油原油的脱水,塑料、橡胶及合成纤维等的制造过程都会用到胶体,正确
本题正确答案是B
考查方向
解题思路

B选项吸热反应主要有大部分分解反应,氢氧化钡晶体和氯化铵固体反应、C + H2O===CO + H2 。而铝热反应即高温下铝与氧化铁反应是放热反应,错误
C选项刚玉、红宝石高温、耐磨主要成分是氧化铝,陶瓷、分子筛主要成分是硅酸盐,正确
D选项分散质粒子直径在1nm~100nm之间的分散系属于胶体,纳米材料的制备,冶金工业中的选矿,石油原油的脱水,塑料、橡胶及合成纤维等的制造过程都会用到胶体,正确
A选项正确,C选项正确,D选项正确,所有选D选项。
易错点
常见吸热反应,胶体本质,氧化还原反应原理
知识点
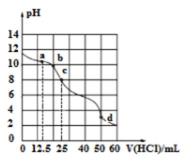
7.在常温下,用0.1000 mol/L的盐酸滴定25 mL 0.1000 mol/L Na2CO3 溶液,所得滴定曲线如下图所示。下
正确答案
解析
在a点处,加入的HCl是Na2CO3量的一半,因此混合后的溶液中溶质为NaHCO3、NaCl、Na2CO3且三者等物质的量,再就是NaHCO3的水解程度没有Na2CO3的强,因此离子浓度大小关系为:c( HCO3-)>c(Cl-)>c(CO32-),A正确。b点溶液中的溶质仍为NaHCO3、NaCl、Na2CO3根据电荷守恒得到:c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+2c(CO32-)+c(OH-),B错误。c点加入的HCl与Na2CO3等物质的量,溶液中的溶质为NaHCO3、NaCl,此时利用电荷守恒与物料守恒得出c(OH-)+c(CO32-)=c(H+)+c(H2CO3),C正确。d点溶液中的溶质全为NaCl,c(Cl-)=c(Na+),D正确。
考查方向
解题思路
先理清溶液中发生的反应,由滴加的HCl的量,判断出溶液的溶质及溶质的量,再利用水解,及三大守恒得到正确选项。
易错点
图形的解读能力不够、以及电解质溶液中的三大守恒运用不好
知识点
7.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
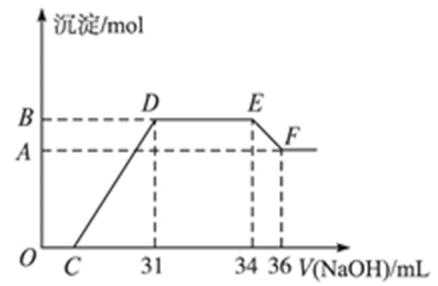
30.某同学取一定量的Al和Fe固体混合物,与2.0 L极稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为_________________________。
在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为______________________;上述现象说明溶液中____________结合OH-的能力比___________强(填写离子符号)。
(2)B与A的差值为______________mol。
(3)B点对应的沉淀的物质的量为____________mol,C点对应的氢氧化钠溶液的体积为______________mL。
(4)求原硝酸溶液的物质的量浓度?
正确答案
(1)
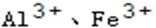
(2)0.008
(3)0.032 ;7
(4)0.074
解析
解析已在路上飞奔,马上就到!
知识点
2. 海洋中的珊瑚虫经如下反应形成石灰石外壳,进而形成珊瑚:
正确答案
解析
A.由Ca2++2HCO3-⇌CaCO3+H2O+CO2可知,共生藻类消耗CO2,促使平衡正向移动,有利于珊瑚的形成,故A正确;
B.由Ca2++2HCO3-⇌CaCO3+H2O+CO2可知,海洋中CO2浓度升高,促使平衡逆向移动,不利于珊瑚的形成,故B正确;
C.升高温度,二氧化碳溶解度降低,故C错误;
D.将CO2转化为甲醇等化工原料,能够消耗二氧化碳,减少大气中二氧化碳含量,有助于缓解温室效应,故D正确
考查方向
化学平衡移动、温室效应
解题思路
A.依据Ca2++2HCO3-⇌CaCO3+H2O+CO2结合平衡移动原理解答;
B.依据Ca2++2HCO3-⇌CaCO3+H2O+CO2结合平衡移动原理解答;
C.依据温度对二氧化碳溶解度影响解答;
D.二氧化碳是引起温室效应主要原因
易错点
C项:升高温度,二氧化碳溶解度降低
教师点评
本题通过珊瑚的形成过程考查了化学平衡移动原理的应用,温室效应,题目难度不大
知识点
从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
15.古代中国四大发明之一的司南是由天然磁石制成的,其主要成分是 (填字母序号)。
a. Fe
b. FeO
c. Fe3O4
d. Fe2O3
16.现代利用铁的氧化物循环裂解水制氢气的过程如下图所示。整个过程与温度密切相关,当温度低于570℃时,Fe3O4(s)和CO(g)反应得到的产物是Fe(s)和CO2(g),阻碍循环反应的进行。
① 已知:Fe3O4(s) + CO(g) 
3FeO(s) + H2O(g) 
17.① 古老而神奇的蓝色染料普鲁士蓝的合成方法如下:
复分解反应ii的离子方程式是 。
② 如今基于普鲁士蓝合成原理可检测食品中CN-,方案如下:
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用 。
正确答案
c
解析
记忆为主。根据别名和用途来选择。
考查方向
铁及其化合物的知识
解题思路
记忆为主,四氧化三铁又名磁性氧化铁。
易错点
易错点是容易选择铁,但是铁在自然界中没有游离态,仅有的是来自于太空的陨石。
教师点评
考察铁的有关性质和用途。
正确答案
正确答案
① 3[Fe(CN)6]4- + 4Fe3+ === Fe4[Fe(CN)6]3↓
② 碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-;Fe2+被空气中O2氧化生成Fe3+;
[Fe(CN)6]4- 与Fe3+反应生成普鲁士蓝使试纸显蓝色。
(1)下列叙述正确的是________。
A.“接触法”制H2SO4时,催化氧化阶段的反应原理为
B. 海水提镁的主要步骤为
C. 普通水泥的主要成分是硅酸钙
D. 黏土的主要成分是三氧化二铝
(2)工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为________;
②硫酸钠和焦炭、石灰石反应的化学方程式为________(已知产物之一为CaS);
2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
①图中的中间产物C是________,D________。(写化学式);
②装置乙中发生反应的化学方程式为________;
3)联合制碱法对氨碱法的改进,其优点是________;
4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?________。
正确答案
(1)AC
(2)1)①2NaCl+H2SO4(浓)


解析
(1)A为接触法制硫酸的基本原理;B镁工业先期加入的是石灰不是石灰石,后期电解的也不是氯化镁溶液;C普通水泥的成分为硅酸二钙、硅酸三钙、铝酸三钙,说主要成分是硅酸钙正确;黏土的主要成分是二氧化硅,还有氧化镁、碳酸钙和三氧化二铝。(2)1)是考查工业生产中的基本原理;2)是生产过程中工艺的考查,在细读生产工艺图中各物质的变化后,可得出;3)考查对教材知识的掌握情况;4)分析图可看出NaHCO3与新信息KHCO3在溶解度图中的差别,可推测溶解度的差别是判断的依据。
知识点
月球的矿产资源极为丰富,仅月球表层5 cm厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石CaMgSi2O6、斜长石CAlSi3O8和橄榄石(Mg或Fe)2SiO4等,下列说法或分析不正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析