- 海水资源及其综合利用
- 共118题
溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在 条件下进行,目的是为了避免
(2)Br2可用热空气吹出,其原因是
(3)写出步骤③所发生的化学反应方程式。
用硫酸而不用盐酸酸化的原因可能是 。
步骤②的产品有时运输到目的地后再酸化,主要是因为
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中
A.通入HBr
B.加入Na2CO3溶液
C.加入NaBr溶液
D.加入Na2SO3溶液
正确答案
见解析。
解析
(1)通风橱,污染环境。
(2)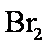
(3)3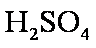
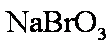
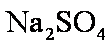
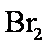
若用盐酸酸化,盐酸会被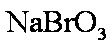
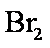
(4)C
知识点
海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是
正确答案
解析
略
知识点
将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾,溴,镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是:Br2+Na2CO3+H2O 
(3)海水提镁的一段工艺流程如下图:
浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
(4)采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
正确答案
(1)②③④
(2)
(3)



(4) 


解析
略
知识点
海水中蕴藏着丰富的资源,人类需要的很多材料都来源于海水的综合利用。
(1)下列有关海水综合利用的说法中正确的是 ( )
A.只需通过物理变化,可从海水中得到钾单质
B.海水通过蒸发可得到淡水,通过蒸馏可得到粗盐
C.从海水中可制取溴及其化工产品
D.利用潮汐发电是将化学能转化为电能
(2)写出工业上用MgCl2制备金属镁的化学方程式
(3)海水中丰富的氯化钠是重要的化工原料,如电解饱和食盐水可制备多种化工产品。
①用石墨电极电解饱和食盐水时,阳极的电极反应式是
②利用下图装置电解饱和食盐水,其中a为饱和食盐水,X和Y是惰性电极。
电解可制备“84”消毒液(主要成分是NaClO)。通电时阳极产生的气体被溶液完全吸收,若所得消毒液仅含一种溶质,电解的总化学方程式是 。“84”消毒液在常温下的
PH 7,用离子方程式表示其原因 。
(4)工业上利用一定的装置电解硫酸钾溶液可制取氢气、氧气、硫酸和氢氧化钾。若将制得的氢气、氧气和氢氧化钾溶液组合成氢氧燃料电池,则电池负极的电极反应式为 。
正确答案
见解析。
解析
(1) C
(2)
(3)① 2Cl--2e-=Cl2↑
② NaCl+H2O

(4)H2+2OH--2 e-=2H2O
知识点
下列说法不正确的是:
正确答案
解析
略
知识点
扫码查看完整答案与解析













