- 海水资源及其综合利用
- 共118题
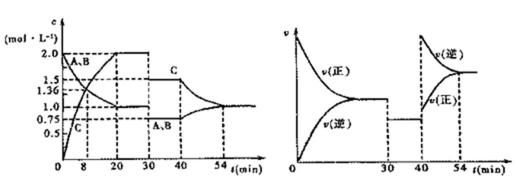
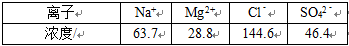
18.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应: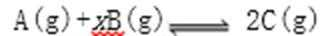
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.下列反应Ⅰ和反应Ⅱ属于同一种反应类型的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7. FeCl3溶液与KSCN溶液混合时存在下列平衡:Fe3+(aq)+SCN﹣(aq)⇌Fe(SCN)2+(aq) 已知某一条件下,反应达到平衡时,Fe(SCN)2+的物质的量浓度与温度的关系如图所示,下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
14.利用下列实验器材(规格和数量不限),不能完成相应实验的选项是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
25.下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水
②提高部分产品的质量
③优化提取产品的品种
④改进钾.溴.镁的提取工艺
26.采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是:Br2+Na2CO3+H2O—NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
27.海水提镁的一段工艺流程如下图:
浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×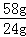
故答案为:Ca2++SO42﹣=CaSO4↓;Mg(OH)2;69.6;
正确答案
②③④
解析
①混凝法是加入一种混凝剂,使水中细小的悬浮物质和胶体聚集成较大颗的颗粒而沉淀,然后过滤除去,海水中可溶性杂质不能除去,不能进行海水淡化,故①错误;
②改进工艺,尽可能减少新物质引入,除去粗产品中的杂质,可以提高产品的质量,故②正确;
③海洋是一个远未完全开发的巨大化学资源宝库,海水中元素种类很多,改进工艺可以优化提取产品的品种,故③正确;
④根据不同的提取原理可以改进钾、溴、镁等的提取工艺,从而提高K、Br2、Mg等的提取质量,故④正确;
故选:②③④;
考查方向
解题思路
混凝法使的悬浮物质和胶体聚集成较大颗的颗粒而沉淀,然后过滤除去,不能进行海水淡化,通过改变工艺,可以提高部分产品的质量,优化提取产品的品种,可以根据不同的原理改进钾、溴、镁等的提取工艺;
反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为5:1,据此计算;
工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg2计算氢氧化镁的质量;
电解熔融氯化镁得到Mg与氯气;电解时,若有少量水存在,Mg与水反应生成氢氧化镁与氢气,会造成产品镁的消耗.
易错点
本题考查海水资源开发利用、氧化还原反应计算、电解原理等,是对基础知识的综合运用,需要学生具备扎实的基础,题目难度中等。
正确答案
解析
反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂=2×5×n还原剂,故n氧化剂:n还原剂=5:1,故吸收1mol Br2时,转移的电子数为1mol×2×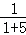
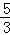
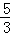
考查方向
海水资源及其综合利用;原电池和电解池的工作原理。
解题思路
混凝法使的悬浮物质和胶体聚集成较大颗的颗粒而沉淀,然后过滤除去,不能进行海水淡化,通过改变工艺,可以提高部分产品的质量,优化提取产品的品种,可以根据不同的原理改进钾、溴、镁等的提取工艺;
反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为5:1,据此计算;
工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg2计算氢氧化镁的质量;
电解熔融氯化镁得到Mg与氯气;电解时,若有少量水存在,Mg与水反应生成氢氧化镁与氢气,会造成产品镁的消耗.
易错点
本题考查海水资源开发利用、氧化还原反应计算、电解原理等,是对基础知识的综合运用,需要学生具备扎实的基础,题目难度中等。
正确答案
Ca2++SO42﹣=CaSO4↓;Mg(OH)2;69.6;
解析
工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,用Ca2+沉淀SO42﹣生成CaSO4沉淀,离子方程式为:Ca2++SO42﹣=CaSO4↓,采用过滤的方法得到产品1为CaSO4,滤液中加入石灰乳,发生反应为Mg2++2OH﹣=Mg(OH)2↓,合成中应得到Mg(OH)2沉淀,过滤、干燥的产品2为Mg(OH)2,溶液中m=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
考查方向
海水资源及其综合利用;原电池和电解池的工作原理。
解题思路
混凝法使的悬浮物质和胶体聚集成较大颗的颗粒而沉淀,然后过滤除去,不能进行海水淡化,通过改变工艺,可以提高部分产品的质量,优化提取产品的品种,可以根据不同的原理改进钾、溴、镁等的提取工艺;
反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为5:1,据此计算;
工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg2计算氢氧化镁的质量;
电解熔融氯化镁得到Mg与氯气;电解时,若有少量水存在,Mg与水反应生成氢氧化镁与氢气,会造成产品镁的消耗.
易错点
本题考查海水资源开发利用、氧化还原反应计算、电解原理等,是对基础知识的综合运用,需要学生具备扎实的基础,题目难度中等。
正确答案
28.采用石墨阳极.不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
MgCl2
Mg+2H2O
解析
电解熔融氯化镁得到Mg与氯气,电解反应方程式为:MgCl2

故答案为:MgCl2

考查方向
解题思路
混凝法使的悬浮物质和胶体聚集成较大颗的颗粒而沉淀,然后过滤除去,不能进行海水淡化,通过改变工艺,可以提高部分产品的质量,优化提取产品的品种,可以根据不同的原理改进钾、溴、镁等的提取工艺;
反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为5:1,据此计算;
工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg2计算氢氧化镁的质量;
电解熔融氯化镁得到Mg与氯气;电解时,若有少量水存在,Mg与水反应生成氢氧化镁与氢气,会造成产品镁的消耗.
易错点
本题考查海水资源开发利用、氧化还原反应计算、电解原理等,是对基础知识的综合运用,需要学生具备扎实的基础,题目难度中等。
扫码查看完整答案与解析