- 海水资源及其综合利用
- 共118题
12.关于下列四幅图中相应实验的说法错误的是
正确答案
解析
A.Cu、Zn原电池中,活泼金属为负极,则根据检流计(G)中指针偏转的方向可比较Zn、Cu的金属活泼性,故A正确;
B.析氢腐蚀生成氢气,气体增多,液面下降,而吸氧腐蚀中氧气得电子,气体减少,液面上升,所以是吸氧腐蚀,故B正确;
C.中和热测定应准确测定反应放出的热量,而热量的测定要准确测定反应前后的温度变化,而用环形铜棒,由于铜具有很强的导电性,所以会影响所测中和热的数值,故C错误;
D.热水中颜色深,则逆反应为吸热反应,所以正反应为放热反应,故D正确;
考查方向
解题思路
A.活泼金属为负极,检流计(G)中指针偏转的方向可比较Zn、Cu的金属活泼性;B.析氢腐蚀生成氢气,气体增多,吸氧腐蚀中氧气得电子,气体减少,则根据试管中液面的升降可判断铁钉发生的是析氢腐蚀还是吸氧腐蚀;
C.中和热测定应准确测定反应放出的热量,而热量的测定要准确测定反应前后的温度变化;
D.热水中颜色深,则逆反应为吸热反应,所以正反应为放热反应,
易错点
选项C为解答的易错点,不能准确把握中和热测定的实质。
知识点
10.亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按图装置进行制取。
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)用50%双氧水配制30%的H2O2溶液,需要的玻璃仪器除玻璃棒、胶头滴管、烧杯外,还需要________(填仪器名称);
(2)装置C的作用是________________________;
(3)装置B内生成的ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为________________________。
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是________________;
(5)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作iii。
i. 55℃蒸发结晶;
ii.趁热过滤;
iii. ________;
iv.低于60℃干燥,得到成品。
实验Ⅱ:样品杂质分析与纯度测定
(6)上述实验制得的NaClO2晶体中含少量Na2SO4。产生Na2SO4最可能的原因是________;
a. B中有SO2气体产生
b. B中浓硫酸挥发进入D中与NaOH中和
c. B中的硫酸钠进入到D装置内
(7)测定样品中NaClO2的纯度。测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。
取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是________;
②所称取的样品中NaClO2的物质的量为________(用含c、V的代数式表示)。
正确答案
(1)量筒
(2)防止D瓶溶液倒吸到B瓶中(或安全瓶)
(3)2ClO2 + 2NaOH + H2O2 = 2NaClO2 + O2 + 2H2O
(4)NaClO3和NaCl
(5)用45℃左右的热水洗涤3遍(热水温度高于38℃,低于60℃)
(6)a
(7)①滴到最后一滴,溶液蓝色恰好褪去且半分钟内不复原
②c•V•10-3mol
解析
(1)用50%双氧水配制30%的H2O2溶液,需要的仪器有量筒、烧杯、玻璃棒、胶体滴管,所以还需要量筒,故答案为:量筒;
(2)装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中,故答案为:防止D瓶溶液倒吸到B瓶中(或安全瓶);
(3)装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,反应的方程式为2NaClO3+Na2SO3+H2SO4=2 ClO2↑+2Na2SO4+H2O,二氧化氯和双氧水、氢氧化钠反应生成NaClO2,反应方程式为2ClO2+2NaOH+H2O2=2NaClO2+O2+2H2O,
故答案为:2ClO2+2NaOH+H2O2=2NaClO2+O2+2H2O;
(4)由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl,
故答案为:NaClO3和NaCl;
(5)从装置D的溶液获得NaClO2晶体,需要蒸发结晶、趁热过滤、洗涤、干燥操作,所以第iii操作是用45℃左右的热水洗涤3遍(热水温度高于38℃,低于60℃),故答案为:用45℃左右的热水洗涤3遍(热水温度高于38℃,低于60℃);
(6)B中可能发生Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,产生的SO2 被带入D中,SO2与H2O2 反应生成硫酸钠,浓硫酸难挥发,硫酸钠是难挥发的盐,不会进入D,故a正确,b、c错误,故选:a;
(7)①碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴Na2S2O3标准液时溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点,
故答案为:滴加最后一滴Na2S2O3标准液时,溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点;
②令样品中NaClO2的物质的量x,则:
NaClO2~2I2~4S2O32-,
1mol 4mol
0.25x c mol•L-1×V×10-3L
故x=c•V•10-3mol,
故答案为:c•V•10-3 mol.
考查方向
解题思路
(1)根据仪器用途选取仪器;
(2)装置C的作用是安全瓶,有防倒吸作用;
(3)装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,二氧化氯和氢氧化钠反应生成NaClO2;
(4)由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl;
(5)从装置D的溶液获得NaClO2晶体,需要蒸发结晶、趁热过滤、洗涤、干燥;
(6)B中可能发生Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,产生的SO2 被带入D中,SO2与H2O2 反应生成硫酸钠;
(7)①碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴Na2S2O3标准液时溶液蓝色恰好褪去且半分钟内不复原,说明到达滴定终点;
②根据化学反应可得关系式:NaClO2~2I2~4S2O32-,令样品中NaClO2的物质的量x,根据关系式计算.
易错点
(5)容易漏掉洗涤液温度的范围
知识点
研究发现,NOx和SO2是雾霾的主要成分。
(一)NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)
2CO(g)+O2(g)
(二)SO2主要来源于煤的燃烧。燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。
21.为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。写出该反应的热化学方程式____________。
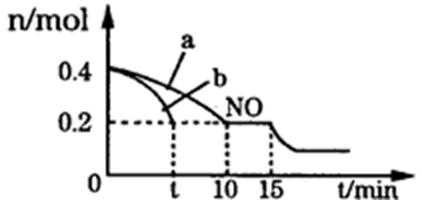
22.T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,保持温度和体积不变,反应过程(0-15min)中NO的物质的量随时间变化如图所示。①T℃时该化学反应的平衡常数K=_________;平衡时若保持温度不变,再向容器中充入CO、N2各0.8 mol,平衡将_______移动。(填“向左”、“向右”或“不”)
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是__________。(填“a”或“b”
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是____________。
23.用纯碱溶液吸收SO2可将其转化为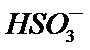
24.如图电解装置可将雾霾中的NO、SO2分别转化为 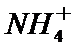

①写出物质A的化学式_____________,阳极的电极反应式是____________Cl。
②该电解反应的化学方程式为________________。
正确答案
2NO(g)+2CO(g)2CO2(g)+N2(g) △H =-746.50 kJ·mol-1
解析
为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环。该反应的热化学方程式2NO(g)+2CO(g)==2CO2(g)+N2(g) △H =-746.50 kJ·mol-1。(△H总 =-△H1+△H2)
考查方向
解题思路
△H总 =-△H1+△H2
易错点
化学平衡移动、电极反应式的书写。
正确答案
【答案】①5(mol/L)-1 向右
②b ③增加CO的物质的量浓度或增大压强
解析
①T℃时该化学反应的平衡常数K=c(CO2)2 c(N2)/ c(CO)2 c(NO)2==5(mol/L)-1;
平衡时若保持温度不变,再向容器中充入CO、N2各0.8 mol,平衡将向右移动。
②图中a、b分别表示在一定温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大则反应的速度快,则曲线是b。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,2NO(g)+2CO(g)==2CO2(g)+N2(g) △H =-746.50 kJ·mol-1。可知正反应适合于加压反应和降温,n(NO)发生如图所示的变化是减少发生正向反应,则改变的条件可能是增加CO的物质的量浓度或增大压强。
考查方向
解题思路
①K=c(CO2)2 c(N2)/ c(CO)2 c(NO)2;
②催化剂表面积较大则反应的速度快。
③2NO(g)+2CO(g)==2CO2(g)+N2(g) △H =-746.50 kJ·mol-1。可知正反应适合于加压反应和降温,n(NO)发生如图所示的变化是减少发生正向反应。
易错点
化学平衡移动、电极反应式的书写。
正确答案
H2O + 2SO2 + CO32- == 2HSO3- + CO2↑
解析
用纯碱溶液吸收SO2可将其转化为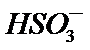
考查方向
解题思路
用纯碱溶液吸收SO2可将其转化为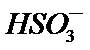
易错点
化学平衡移动、电极反应式的书写。
正确答案
① H2SO4 SO2 + 2H2O -2 e-==SO42- +4H+
②5SO2+ 2NO+ 8H2O
解析
电解装置可将雾霾中的NO、SO2分别转化为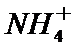
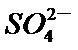
①物质A的化学式H2SO4,阳极的电极反应式是SO2 + 2H2O -2 e-==SO42- +4H+。
②该电解反应的化学方程式为5SO2+ 2NO+ 8H2O
考查方向
解题思路
①物质A的化学式H2SO4,阳极的电极反应式是SO2 + 2H2O -2 e-==SO42- +4H+。
②该电解反应的化学方程式为5SO2+ 2NO+ 8H2O
易错点
化学平衡移动、电极反应式的书写。

下列说法错误的是
正确答案
解析
①Cl2+2Br–→Br2+2Cl– ;②使溴挥发富集;③吸收与富集:SO2+Br2+2H2O→2HBr+H2SO4,故B.错误;④Cl2+2Br–→Br2+2Cl–。
考查方向
解题思路
氯气置换溴,SO2还原单质溴。
易错点
C.步骤②③的目的是富集溴元素。
知识点
氢溴酸是无色、易挥发的液体,在化工领域用途广泛。实验室模拟一种工业制备氢溴酸的主要流程如下:
反应③
32.写出反应①的离子方程式 
33.操作I的名称 。
34.反应②中Na2SO3的目的是 。
35.操作Ⅱ用到的玻璃仪器有烧杯、 。
36.工业生产中制得的氢溴酸带有淡淡的黄色。于是甲乙两同学设计了实验加以探究:①甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。②乙同学假设工业氢溴酸呈淡黄色是因为 ,其用于证明该假设成立的方法为 。
正确答案
32.SO2+Br2+2H2O→SO42—+2Br—+4H+;增大二氧化硫、溴、溴化氢的溶解度
解析
(32)反应室①中SO2和Br2在冰水中发生反应的化学方程式为SO2+Br2+2H2O=H2SO4+2HBr。
考查方向
解题思路
工业流程提的解题思路:更好、更快、更多、更经济、更环保、更安全
易错点
方程式书写、操作的文字表述
正确答案
33.蒸馏
解析
(33)反应室①使用冰水的目的是为了防止Br2和HBr挥发而污染空气,影响操作。
考查方向
解题思路
工业流程提的解题思路:更好、更快、更多、更经济、更环保、更安全
易错点
方程式书写、操作的文字表述
正确答案
34.除去粗品中的溴
解析
(34)操作I是分离互溶的沸点不同的液体物质的操作。名称是蒸馏。操作Ⅱ用到的玻璃仪器有漏斗、玻璃棒、烧杯。
考查方向
解题思路
工业流程提的解题思路:更好、更快、更多、更经济、更环保、更安全
易错点
方程式书写、操作的文字表述
正确答案
35.玻璃棒、漏斗
解析
(35)反应室②中加入Na2SO3的目的是为了消耗为反应的Br2,提高物质的纯度。
考查方向
解题思路
工业流程提的解题思路:更好、更快、更多、更经济、更环保、更安全
易错点
方程式书写、操作的文字表述
正确答案
36.①KSCN;取样,滴加KSCN溶液,若溶液变为红色,则证明含Fe3+(其他合理的答案也给分)②Br2(或溴);取样,加入CCl4少
解析
(36)工业生产中制得的氢溴酸带有淡淡的黄色。①甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+。检验的方法是取少量的溶液,向其中滴加几滴KSCN溶液,若工业氢溴酸遇KSCN溶液变红色;就证明含有Fe3+;否则就吧含有Fe3+。②乙同学假设工业氢溴酸呈淡黄色是因为含有Br2。检验的方法是利用其强氧化性。用玻璃棒蘸取制得的氢溴酸,点在湿润淀粉KI试纸上变蓝(也可以利用其在有机溶剂中的溶解度大的性质。用胶头滴管取制得的氢溴酸于试管中,滴加CCl4、振荡、静止,下层呈橙红色),证明因含Br2而显黄色。
考查方向
解题思路
工业流程提的解题思路:更好、更快、更多、更经济、更环保、更安全
易错点
方程式书写、操作的文字表述
扫码查看完整答案与解析