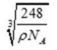- 海水资源及其综合利用
- 共118题
H、C、N、O、Na、Fe、Cu是常见的七种元素,请回答下列问题:
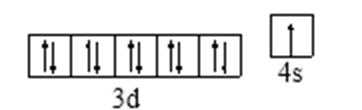
23.N、O、Na原子第一电离能由小到大的顺序是 (用元素符号和“<”表示);Cu原子的特征电子轨道式为 。
24.N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是_____;Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为 ,水分子与铜离子间结合的化学键名称为 。
25.根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是_____(填序号):①H3O+ 、②H2O、 ③NO2+ 、④NO2- 。
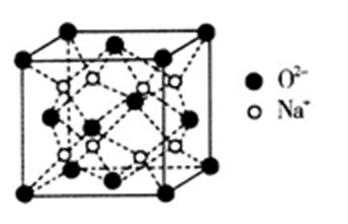
27.O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,该离子化合物的化学式为___________;已知该晶胞的密度为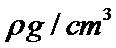

正确答案
Na<O<N
解析
H、C、N、O、Na、Fe、Cu是常见的七种元素,(1)N、O、Na原子第一电能最小的是Na,最大的是N,N处于半充满状态,所以有小到大的顺序为Na<O<N;Cu原子的特征电子轨道式为。
考查方向
解题思路
H、C、N、O、Na、Fe、Cu是常见的七种元素,N、O、Na原子第一电离能由小到大的排序时,不要忘了N是半充满状态, N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数分别是3、0、5、1,最多的是Fe3+;配位化合物的化学键名称为配位键,这四种粒子的空间构型①H3O+ 是三角锥形、②H2O是V型 ③NO2+ 是直线型 ④NO2- 是V型 ; O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,其中Na的原子个数为:体内有8个,O有8·1 /8+6·1 /2=4,其化学式为Na2O,已知该晶胞的密度为
易错点
不同周期的元素的电能能大小的规律和元素周期律记忆不清,元素电子的电子排布式和电子排布图的理解错误,核外电子的电子排布图和配位化合物与配位键的理解失误,根据VSEPR模型判断分子或离子的空间构型理解失误,计算出错,身体不仔细。
正确答案
e3+ [Cu(H2O)4]2+ 配位键
解析
N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数分别是3、0、5、1,最多的是Fe3+;Cu2+在水中呈现蓝色是因为形成了水合铜离子,其化学式为[Cu(H2O)4]2+,水分子与铜离子间结合的化学键名称为配位键。
考查方向
解题思路
H、C、N、O、Na、Fe、Cu是常见的七种元素,N、O、Na原子第一电离能由小到大的排序时,不要忘了N是半充满状态, N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数分别是3、0、5、1,最多的是Fe3+;配位化合物的化学键名称为配位键,这四种粒子的空间构型①H3O+ 是三角锥形、②H2O是V型 ③NO2+ 是直线型 ④NO2- 是V型 ; O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,其中Na的原子个数为:体内有8个,O有8·1 /8+6·1 /2=4,其化学式为Na2O,已知该晶胞的密度为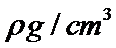
易错点
不同周期的元素的电能能大小的规律和元素周期律记忆不清,元素电子的电子排布式和电子排布图的理解错误,核外电子的电子排布图和配位化合物与配位键的理解失误,根据VSEPR模型判断分子或离子的空间构型理解失误,计算出错,身体不仔细。
正确答案
② ④
解析
根据价层电子对互斥理论下列分子或离子中空间构型分别是:①H3O+ 是三角锥形、②H2O是V型 ③NO2+ 是直线型 ④NO2- 是V型 ,所以选②和④;。
考查方向
解题思路
H、C、N、O、Na、Fe、Cu是常见的七种元素,N、O、Na原子第一电离能由小到大的排序时,不要忘了N是半充满状态, N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数分别是3、0、5、1,最多的是Fe3+;配位化合物的化学键名称为配位键,这四种粒子的空间构型①H3O+ 是三角锥形、②H2O是V型 ③NO2+ 是直线型 ④NO2- 是V型 ; O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,其中Na的原子个数为:体内有8个,O有8·1 /8+6·1 /2=4,其化学式为Na2O,已知该晶胞的密度为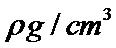
易错点
不同周期的元素的电能能大小的规律和元素周期律记忆不清,元素电子的电子排布式和电子排布图的理解错误,核外电子的电子排布图和配位化合物与配位键的理解失误,根据VSEPR模型判断分子或离子的空间构型理解失误,计算出错,身体不仔细。
正确答案
Na2O
解析
O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,其中Na的原子个数为:体内有8个,O有8·1 /8+6·1 /2=4,其化学式为Na2O;已知该晶胞的密度为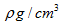
考查方向
解题思路
H、C、N、O、Na、Fe、Cu是常见的七种元素,N、O、Na原子第一电离能由小到大的排序时,不要忘了N是半充满状态, N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数分别是3、0、5、1,最多的是Fe3+;配位化合物的化学键名称为配位键,这四种粒子的空间构型①H3O+ 是三角锥形、②H2O是V型 ③NO2+ 是直线型 ④NO2- 是V型 ; O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,其中Na的原子个数为:体内有8个,O有8·1 /8+6·1 /2=4,其化学式为Na2O,已知该晶胞的密度为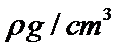
【解析
O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,其中Na的原子个数为:体内有8个,O有8·1 /8+6·1 /2=4,其化学式为Na2O;已知该晶胞的密度为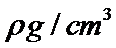
易错点
不同周期的元素的电能能大小的规律和元素周期律记忆不清,元素电子的电子排布式和电子排布图的理解错误,核外电子的电子排布图和配位化合物与配位键的理解失误,根据VSEPR模型判断分子或离子的空间构型理解失误,计算出错,身体不仔细。
7.常温下,下列有关叙述正确的是()
正确答案
解析
A选项中,NaY溶液中电荷守恒是:c(Na+) +c(H+) =c(OH-) +c(Y-),移项为c(Na+) -c(Y-) =c(OH-) +c(H+)。因为该溶液中的PH=8,则c(H+) =10-8,c(OH-) =10-6,所以c(Na+) -c(Y-) =c(OH-) +c(H+) =10-6-10-8=9.9×10-7mol/L,所以A正确。 B选项Na2CO3溶液中物料守恒正确的应该是:c(Na+)=2 [c(CO32-)+c(HCO3-)+c(H2CO3) ],所以B错误。 C选项中pH相等的①NH4NO3、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)的最大的是第②个,应为他电离出来的NH4+是最多的,再下来是考虑水解,但是第③个电离的时候会产生H+,会抑制NH4+的水解,再下来是①个,因为①中没有抑制NH4+水解的物质存在,所以,三种溶液中c(NH4+)的大小顺序②>③>①,故C错。 D选项中如果HA是弱酸,则不符合题目要求,所以D错。
考查方向
解题思路
写出A和B选项中盐溶液中的电荷守恒和物料守恒,结合题中的所给的条件加以推断即可,对于C选项中,要考虑盐类水解,水解有促进的,也有抑制的因素,充分考虑清楚即可判断,对于D中要考量两方面,第一种情况是HA是强酸,另外一种情况HA是弱酸,再结合选项来看就不难判断了。
易错点
不仔细审题 ,对盐溶液中的物料守恒、电荷守恒、质子守恒的理解判断错误,盐溶液中各种离子的变化情况判断失误,对于不确定的因素没有加以论证,也会出现错误。
知识点
一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取草酸钴的工艺流程如下
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
18.浸出过程中加入Na2SO3的目的是_____________。
19.制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为 ;实验需要制取10.65 g NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为_________ (标准状况)。
20.萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______(填选项序号)。
A.接近2.0
B.接近3.0
C.接近5.0
21.“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c(Ca2+)=___________。
22.工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离平衡常数Kb=1.8×10-5mol·L-1 ,H2SO3的电离平衡常数Ka1=1.2×10-2mol·L-1 ,Ka2 =1.3×10-8mol·L-1。在通入废气的过程中:
①当恰好形成正盐时,溶液中离子浓度的大小关系为____________。
②当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为____________。
正确答案
将Co3+、Fe3+还原
解析
已知水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等],盐酸浸取——即碱性氧化物与酸反应生成盐和水,但是不是Co3+、Fe3+盐,而是Co2+、Fe2+(①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等)盐,显然,这是被Na2SO3还原的结果。故浸出过程中加入Na2SO3的目的是还原Co3+、Fe3+。
考查方向
解题思路
依据无机物性质、氧化还原反应规律、溶度积、盐类的水解等知识点解题。
正确答案
3Cl2+6OH-
6.72 L
解析
制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液——其反应物是氯气和浓氢氧化钠溶液,生成物有NaClO3,可知这是氯气的歧化反应,另一还原产物是氯化钠。则该反应的离子方程式为3Cl2+6OH-
实验需要制取10.65 g NaClO3,……则同时生成的氢气的体积为____(标准状况)。
依据: 3Cl2 ~ NaClO3
3×22.4 L 106.5 g
V(Cl2) 10.65 g
V(Cl2)= 10.65 g×3×22.4 L÷106.5 g=6.72 L
考查方向
解题思路
依据无机物性质、氧化还原反应规律、溶度积、盐类的水解等知识点解题。
正确答案
除去Mn2+ B
解析
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,加NaClO3后Fe2+就被氧化为Fe3+,再加Na2CO3调节pH=5.2,就沉淀除去Fe3+和Al3+,滤液I中剩下的有Co2+、Mn2+、Ca2+、Mg2+;再往滤液I中加NaF溶液,又沉淀除去Ca2+、Mg2+,滤液II中就剩下Co2+、Mn2+,因此,滤液Ⅱ中还需要除去的离子只有Mn2+,故往滤液Ⅱ中加入萃取剂的作用是除去Mn2+;
依据萃取剂对金属离子的萃取率与pH的关系图,既要萃取除去Mn2+,又要留下Co2+,使用萃取剂适宜的pH是 B.接近3.0。A.接近2.0——此时Mn2+萃取不完全;C.接近5.0——此时Co2+也被大量萃取到萃取剂中而除掉。
考查方向
解题思路
依据无机物性质、氧化还原反应规律、溶度积、盐类的水解等知识点解题。
易错点
滤液Ⅱ中加入萃取剂的作用是?;以及使用萃取剂适宜的pH的选择。
正确答案
0.7
解析
已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c(Ca2+)=Ksp(MgF2)/ Ksp(CaF2)= 7.35×10-11/1.05×10-10=0.7
考查方向
解题思路
依据无机物性质、氧化还原反应规律、溶度积、盐类的水解等知识点解题。
正确答案
①c(NH4+) >c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
②HSO3-+ OH-= SO32-+ H2O
解析
用氨水吸收SO2。已知NH3·H2O的电离平衡常数Kb=1.8×10-5mol·L-1 ,H2SO3的电离平衡常数Ka1=1.2×10-2mol·L-1 ,Ka2 =1.3×10-8mol·L-1。
①(NH4)2SO3溶液中,因为Ka2<Kb,故SO32-的水解强于铵离子,且水解显碱性(谁强显谁性),离子浓度的大小关系为c(NH4+) >c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。
②当恰好形成酸式盐时,加入少量NaOH溶液,因氢氧化钠量少,故只中和酸式盐中的氢离子,且Ka1>Kb,NH4HSO3以电离为主——HSO3-的电离强于水解,溶液显酸性,因此反应的离子方程式为HSO3-+ OH-= SO32-+ H2O。
考查方向
解题思路
依据无机物性质、氧化还原反应规律、溶度积、盐类的水解等知识点解题。
5.下列表示对应化学反应的离子方程式正确的是()
正确答案
解析
A选项中电荷不守恒,所以A错误; C选项中的产物有AgOH,AgOH在常温状态下很不稳定会很快分解成Ag2O,所以C错误; D选项中的离子方程式没有配平,产物中会出现2mol的水,所以D错误, 所以本题选B。
考查方向
解题思路
首先看电荷是否守恒,再看原来的化学反应方程式拆成离子方程式后有没有不正确的;再看看生成的物质是否有不正确的。
易错点
:不仔细审题 ,对物质的氧化性与还原性强弱判断失误,没有写出正确的化学反应方程式,没有配平,都会导致本题出错。
知识点
6.温度为25℃时,用Na2S沉淀Cu2+、Zn2+两金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列说法不正确的是()
正确答案
解析
逐项筛选如下:
A.是Na2S溶液中物料守恒,但恰好把量的关系弄反,故错误,如此,该题就节省出大量的时间啦!正确的是2[c(S2-)+c(HS-)+c(H2S)]=c(Na+) ;
B.正确,因25℃时,当横坐标lgc(S2-)= -10时,纵坐标lgc(M2+)= -25(图中原点位),故Ksp(CuS)约为1×10-35;
C.正确,向100 mL Zn2+、Cu2+浓度均为10-5 mol/L的混合溶液中逐滴加入10-4 mol/L的Na2S溶液,Cu2+先沉淀,因为Ksp(CuS)<Ksp(ZnS);
D.正确,向Cu2+浓度为10-5 mol/L的工业废水中加入ZnS粉末,会有CuS沉淀析出,因为Ksp(CuS)<Ksp(ZnS),故ZnS可以转化为更难溶的CuS。
考查方向
解题思路
依据盐类水解、及沉淀溶解平衡规律逐项筛选。
易错点
因为对图像中坐标量的识别有误而错选B等。
知识点
扫码查看完整答案与解析