- 中和热的测定
- 共8题
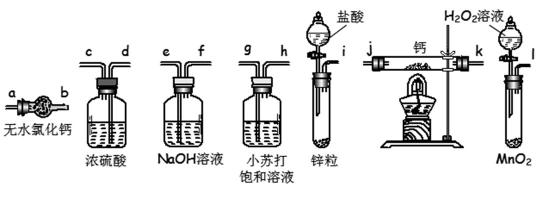
氢化钙固体是登山
请回答下列问题:
8.请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号)
9.根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;____________________(请按正确的顺序填入下列步骤的标号)。
A.加热反应一段时间
B.收集气体并检验其纯度
C.关闭分液漏斗活塞
D.停止加热,充分冷却
10.实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此断,上述实验确有CaH2生成。
① 写出CaH2与水反应的化学方程式 ___________________________
②该同学的判断不正确,原因是_________________________________________
11.请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现___________。
12.登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是______________。
正确答案
i→e,f→d,c→j,k→a或i→e,f→d,c→k,j→a
解析
氢化钙和金属钙都是极强的还原剂,遇水、遇空气都能发生剧烈反应,因此在制取氢化钙时,必须要除去空气、水等其他杂质;在题给的实验装置中,不难判断出氢气的发生装置,氢气的净化装置和氢化钙的生成装置等,其连接顺序为i→e→f→d→c→j→k(或k→j)→a。
考查方向
解题思路
氢化钙和金属钙都是极强的还原剂,遇水、遇空气都能发生剧烈反应,因此在制取氢化钙时,必须要除去空气、水等其他杂质;
易错点
氢化钙和金属钙都是极强的还原剂;CaH 2 和Ca与水反应都能产生Ca(OH) 2 和H 2。
正确答案
BADC
解析
为保证整个装置内已充满氢气,因此实验的操作程序是:检查装置的气密性→产生氢气→收集氢气并进行验纯→加热反应→停止加热→继续通氢气至冷却→停止通入氢气,故答案为BADC。
考查方向
解题思路
为保证整个装置内已充满氢气,因此实验的操作程序是:检查装置的气密性→产生氢气→收集氢气并进行验纯。
易错点
氢化钙和金属钙都是极强的还原剂;CaH 2 和Ca与水反应都能产生Ca(OH) 2 和H 2。
正确答案
①CaH2+H2O
②Ca也可与水反应产生类似现象
解析
CaH 2 和Ca与水反应都能产生Ca(OH) 2 和H 2 ,反应方程式分别为:CaH 2 +2H 2 O=Ca(OH) 2 +2H 2 ↑和Ca+2H 2 O=Ca(OH) 2 +H 2 ↑,因此不能根据反应后溶液呈碱性判断是否含有CaH 2 。
考查方向
解题思路
CaH 2 和Ca与水反应都能产生Ca(OH) 2 和H 2。
易错点
氢化钙和金属钙都是极强的还原剂;CaH 2 和Ca与水反应都能产生Ca(OH) 2 和H 2。
正确答案
取两种固体,在加热情况下,分别与干燥的氧气作用,将产物气体这过无水CuSO4,若观察到无水CuSO4固体由白色变为蓝色,则为CaH2,不变蓝色者为Ca。
解析
CaH 2 可以和氧气在加热条件下反应生成水,可用无水硫酸铜检验,现象是白色变为蓝色。所以实验方案是取适量氢化钙,在加热条件下与干燥氧气反应,将反应气相产物通过装有无水硫酸铜的干燥管,观察到白色变为蓝色;取钙做类似实验,观察不到白色变为蓝色。
考查方向
解题思路
CaH 2 可以和氧气在加热条件下反应生成水,可用无水硫酸铜检验,现象是白色变为蓝色。
易错点
氢化钙和金属钙都是极强的还原剂;CaH 2 和Ca与水反应都能产生Ca(OH) 2 和H 2。
正确答案
CaH2为固体,携带方便。
解析
作为能源,氢化钙明显比氢气更易携带,使用也较方便。所以其优点是氢化钙是固体,携带方便。
考查方向
解题思路
作为能源,氢化钙明显比氢气更易携带,使用也较方便。
易错点
氢化钙和金属钙都是极强的还原剂;CaH 2 和Ca与水反应都能产生Ca(OH) 2 和H 2。
12. 某同学做如下实验

正确答案
解析
A.NO是无色气体、二氧化氮是红棕色气体,Al和稀硝酸反应生成无色的NO,NO不稳定,易被氧气氧化生成红棕色气体二氧化氮,则发生反应2NO+O2=2NO2,故A正确;
B.能使湿润的红色石蕊试纸变蓝色的气体是氨气,根据实验Ⅱ、Ⅲ的气体检验结果及现象知,说明II、III都有NH3产生,故B正确;
C.Al和稀硝酸反应生成NO,其离子方程式为Al+4H++NO3-=Al3++NO↑+2H2O,故C错误;
D.I中生成NO,II、III中生成氨气,I中溶液呈酸性而II和III溶液呈碱性,则在实验Ⅰ、Ⅱ、Ⅲ中,NO3-在酸、碱及中性溶液中都被还原,故D正确;
考查方向
化学实验方案的评价
解题思路
A.NO是无色气体、二氧化氮是红棕色气体;
B.能使湿润的红色石蕊试纸变蓝色的气体是氨气;
C.Al和稀硝酸反应生成NO;
D.I中生成NO,II、III中生成氨气
易错点
铝和浓硝酸发生钝化现象,和稀硝酸反应生成硝酸铝和NO
教师点评
本题考查化学实验方案评价,为高频考点,侧重考查学生分析判断及总结归纳能力,明确实验原理及气体性质是解本题关键,题目难度不大。
知识点
2.下列试验操作及结论正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.节能减排是当下环境保护的重点.
(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),△H<0,800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=l.0
①从起始经过5min达到化学平衡时,用生成物CO2表示该反应的反应速率v(CO2)=_________________;平衡时,容器中CO的转化率为________.
②如图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则t2时刻发生改变的条件可能是_______________________________________.(写出一条)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+O2(g)⇌CO2(g)降低其浓度。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请在表中的空格处填写“>““<”或“=“。
②相同温度下,某汽车尾气中CO、CO2的浓度分别为l. 0×10﹣5mol/L和1.0×l0﹣4mol/L.若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×l0﹣4mol/L,则最终尾气中CO的浓度为__________mol/L(请保留两位有效数字).
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0﹣9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0﹣4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为_________mol/L.
正确答案
(1)0.01mol/(L.min);50%;降低温度或降低H2浓度或增大H2O(g)浓度
(2)>;1.1×10﹣6
(3)5.6×10﹣5
解析
解析已在路上飞奔,马上就到!
知识点
6.下列说法正确的是( )
正确答案
解析
A. c(OH-)/c(H+) = 1012的溶液,显碱性,不能大量存在NH4+、Al3+,故A错误;
B.MgO的熔点高,则可以用作耐火材料,故B正确;
C.淀粉和纤维素都可用(C6H10O5)n表示,n不同,则二者不是同分异构体,故C错误;
D.浓氨水中滴加FeCl3饱和溶液发生复分解反应生成沉淀,在沸水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体,故D错误;
考查方向
离子反应;溶液和胶体;同分异构体
解题思路
A.c(OH-)/c(H+) = 1012的溶液,显碱性;
B.MgO的熔点高;
C.淀粉和纤维素都可用(C6H10O5)n表示,n不同;
D.浓氨水中滴加FeCl3饱和溶液发生复分解反应生成沉淀
易错点
Fe(OH)3胶体的制备
教师点评
本题考查离子共存、物质性质和用途等,为高频考点,把握常见离子之间的反应、复分解反应、同分异构体的判断等为解答的关键,注重基础知识的考查,题目难度不大
知识点
7.下列实验装置,试剂选用或操作正确的是
正确答案
解析
A.NO2可与水反应生成硝酸和NO,但又混入水蒸气,故A错误;
B.氯气与浓硫酸不反应,可用浓硫酸干燥,故B正确;
C.容量瓶只能在常温下使用,不能用于稀释、溶解,应在烧杯中溶解且冷却后转移到容量瓶中,故C错误;
D.过氧化钠和水反应剧烈,不能用简易气体发生装置制备氧气,且气体从长颈漏斗逸出,故D错误.
考查方向
化学实验方案评价
解题思路
A.NO2可与水反应生成硝酸和NO,但又混入水蒸气;
B.氯气可用浓硫酸干燥;
C.不能在容量瓶中稀释浓硫酸;
D.过氧化钠和水反应剧烈,不能用简易气体发生装置制备氧气
易错点
A项中混入水蒸气
教师点评
本题考查较为综合,涉及物质分离、提纯以及气体的制备和容量瓶的使用等,综合考查学生的分析能力和实验能力,难度不大,注意相关基础知识的积累
知识点
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。不能检验溶液A中Fe3+的试剂为_______。(填编号,下同)
①KMnO4 ②(NH4)2S ③NaOH ④KSCN
(2)氧化剂可选用_______。
①Cl2 ②KMnO4 ③HNO3 ④H2O2
(3)要得到较纯的产品,试剂可选用_______。
①NaOH ②FeO ③CuO ④Cu(OH)2 ⑤Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是_______(按实验先后顺序选填编号)。
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需_______,下列滴定方式中,最合理的是_______(夹持部分略去)(填字母序号)。
正确答案
(1)①
(2)①④
(3)③④⑤
(4)②④①
(5)250 mL容量瓶;b
解析
略。
知识点
9.下列实验合理的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析