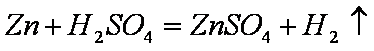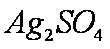- 原电池和电解池的工作原理
- 共168题
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是
正确答案
解析
电镀时Zn 为阳极,Fe为阴极,KCl、ZnCl2的混合溶液为电解质溶液,若未通电,不存在自发进行的氧化还原反应,故不能构成原电池,故A错;电镀时,导线中每通过2 mol电子,就会析出1mol锌,通过的电量与析出的锌量的关系确定,故B错;电镀时保持电流保持恒定,则反应的速率就不会改变,故升高温度对反应的速率无影响,故C正确;镀锌层破损后,锌与铁可构成原电池的两个电极,铁做正极受到保护,故D错。
知识点
右图装置中发生反应的离子方程式为:Zn+2H+→Zn2++H2↑,下列说法错误的是
正确答案
解析
本题通过电化学知识意在考查考生的电化学知识和考生对问题的分析、处理能力。图示装置既可以是电解池,阳极的电极材料为Zn、阴极的电极材料为Zn或其他可导电的材料,如Cu、石墨等,电解质溶液为盐酸或硫酸等,故A项错、B项正确;该装置也可是原电池,此时电池负极材料为Zn、正极材料为比Zn活泼性差的可导电的材料,如Cu、石墨等,电解质溶液为盐酸或硫酸等,故C、D项正确。
知识点
下列实验操作正确的是( )
正确答案
解析
银与氨水不反应,故A错;硅酸钠具有粘性,能将玻璃塞和玻璃瓶粘在一起,故硅酸钠溶液不能保存在带玻璃塞的试剂瓶中,B错;将三氯化铁溶液蒸干,由于HCl具有挥发性,三氯化铁会水解彻底,生成Fe(OH)3,故C错;锌能置换出铜,构成原电池加快了反应速率,故D正确。
知识点
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题;
(1)上述实验中发生反应的化学方程式有
(2)硫酸铜溶液可以加快氢氯生成速率的原因是
(3)实验室中现在Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是 ;
(4)要加快上述实验中气体产生的速率,还可采取的措施有
(答两种);
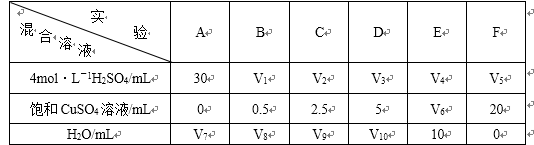
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集4产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②反应一段时间后,实验A中的金属呈 色,实验E中的金属呈 色;
③该同学最后得出的结论为;当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
正确答案
(1)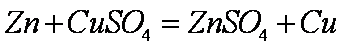
(2)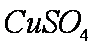
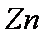
(3)
(4)升高反应温度、适当增加硫酸的浓度、增加锌粒的比表面积等
(5)①30 10 17.5
②灰黑 暗红
③当加入一定量的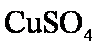
解析
(1)上述实验中发生反应的化学方程式有Zn+CuSO4==ZnSO4+Cu和Zn+H2SO4==ZnSO4+H2。
(2)由于生成了铜,因此已经构成了Zn—Cu原电池,这样便加快了氢气产生的速率。
(3)根据金属活动性顺序表,能与Zn发生置换反应的只有Ag2SO4。
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增大锌粒的表面积等。
(5)①因为生成相同体积的气体,而金属Zn是过量的,则4mol/L H2SO4的体积应相同,所以V1=V2=V3=V4=V5=30mL。又由F可知,溶液的总体积为V5+20 =30+20 =50 mL,因此V6=50 mL-10 mL-30=10 mL;V9=50 mL-2.5 mL-30 mL=17.5 mL。
②由于A中未加入饱和CuSO4溶液,则实验A中的金属呈灰黑色;而E中加入了10 mL的饱和CuSO4溶液,与金属Zn发生了反应生成了单质Cu并沉积在Zn的表面,故实验E中的金属呈暗红色。
③当加入少量CuSO4溶液时,由于构成了Zn—Cu原电池,因而生成氢气的速率会大大提高。当加入一定量的CuSO4后,生成的单质铜会沉积在Zn的表面降低了Zn与溶液接触的表面,使得氢气生成速率反而下降。
知识点
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是
正确答案
解析
由题意知:①②③④ 四种金属片两两相连浸入稀硫酸中都可组成原电池 ,①②相连时,外电路电流从②流向①,则① 大于②;
知识点
扫码查看完整答案与解析