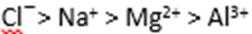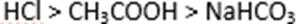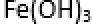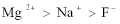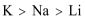- 微粒半径大小的比较
- 共12题
X.Y.Z均为短周期元索,X.Y处于同一周期,X.Z的最低价离子分别为x2-和z-,Y+ 和z-具有相同的电子层结构。下列说法正确的是
正确答案
解析
略
知识点
氮化钠和氢化钠与水反应的化学方程式如下:Na3N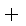
NaH
正确答案
解析
略
知识点
下列比较不正确的是
正确答案
解析
略
知识点
2009年《自然》杂志报道了我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。
完成下列填空:
(1)10Be和9Be_______。
a.是同一种原子
b.具有相同的中子数
c.具有相同的化学性质
d.具有恒定的丰度
Be所在的周期中,最外层有2个未成对电子的元素相互组成的化合物属于_____晶体。
(2)Al和Be具有相似的化学性质,写出BeCl2水解反应的化学方程式_____。
(3)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是____。
a.比较这两种元素的单质的硬度和熔点
b.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.将空气中放置已久的这两种元素的单质分别和热水作用
(4)目前还有一种测量方法叫“钾氩测年法”。写出和Ar核外电子排布相同的阴离子的半径由大到小的顺序______(用化学符号表示);其中一种离子与钾相邻元素的离子所形成的化合物可用做干燥剂,此化合物的电子式是_______。
正确答案
解析



知识点
元素X形

正确答案
解析
A答案中Al的离子半径和钙离子的核外电子排布不同,A错误;P形成的简单离子的半径 大于负二级硫的离子半径,B错误;Ar不能形成简单离子,答案D 。
知识点
方沸石是常见的似长石矿物,为含水的钠铝硅酸盐。在玄武岩、辉绿岩、花岗岩、片石岩和洞穴中及碱性湖底沉积中会有它们的存在。
(1)方沸石的组成元素中,原子核外电子有3种能量状态的元素是_________(填元素符号),原子核外M层上有2个未成对电子的元素其原子最外层电子排布式是_________。
(2)方沸石的组成元素中,具有相同电子层结构的离子其离子半径由小到大的顺序_________,属于第三周期的非金属元素,与氧元素形成的氧化物属于_________晶体。
(3)元素周期表中与氧元素相邻,且非金属性比氧元素强的是_________(填元素符号),能说明它的非金属性比氧强的1个化学方程式是____________________________________。
正确答案
(1)O 3s23p2
(2)Al3+ <Na+ <O2- 原子
(3)F ;2F2 +2H2O→4HF+O2
解析
略
知识点
8.下列顺序不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.归纳总结是学习与研究化学行之有效的方法,某同学在全面复习的基础上作出如下归纳:
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②给出质子能力:CH3COOH>CH3CH2OH>H2O
③相同物质的量浓度溶液中c(NH+4):(NH4)2SO4>(NH4)2CO3>NH4Cl
④微粒半径:r(H+)>r(H)>r(H-)
⑤熔沸点:H2S>H2Se >H2O
⑥不活泼金属单质一定不能与活泼盐溶液反应
以上归纳中正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.下列排列顺序不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.下列各项关系中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析