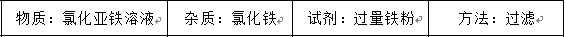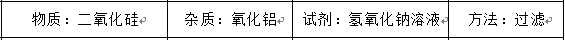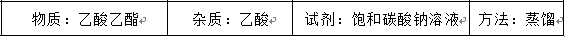- 物质分离和提纯的方法和基本操作综合应用
- 共38题
工业上从废催化剂(主要成分是钯和活性炭,还含有少量铁、锌)中回收钯,采用如下流程:
已知:钯(Pd)的性质与铂相似。钯与王水在加热条件发生的主要反应是:
3Pd +12HCl + 2HNO3 
请回答下列问题:
(1)酸溶I前先将废催化剂在700℃下进行灼烧,同时不断通入空气的作用是_______________
_________________________。加入盐酸的目的是__________________________________。
(2)酸溶Ⅱ需控制温度不宜过高,除了控制一定反应速率外,其原因是_______________________
__________________。
(3)若用足量的烧碱吸收混有空气的气体Ⅱ,吸收后溶液中含有的溶质的化学式有NaOH、NaNO2、___________。
(4)使用甲醛还原钯的化合物时,溶液须保持碱性,否则会造成甲醛的额外损耗,原因是_______________________________________。
(5)操作I的名称是_______________,溶液I可能含有的有机离子为________________。
(6)催化剂中另一主要成分活性炭可以用浓硝酸除去,写出该反应的化学方程式:
_____________________________________________________。
正确答案
(1)除去废催化剂中的活性炭(2分) 除去铁、锌等杂质 (2分)
(2)防止硝酸分解,防止盐酸、硝酸挥发(2分)
(3)NaNO3(2分)(4)酸性条件下,甲醛会被硝酸氧化(2分)
(5)过滤(2分) HCOO−(2分)
(6)C+4HNO3(浓)
解析
略
知识点
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是 。
(2)滤渣的主要成分为TiO2•xH2O,写出TiOSO4水解生成TiO2•xH2O的化学方程式 。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为 。
(4)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因 。
(5)步骤④的离子方程式是 。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及 。
(7)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示) 。
正确答案
见解析。
解析
(1)过滤
(2)TiOSO4 +(x+1)H2O ==TiO2 • xH2O↓+H2SO4
(3)1: 4
(4)
(5)Fe2++2HCO3—==FeCO3↓+H2O+CO2↑
(6)防止Fe2+被氧化
(7)13.9/a
知识点
提纯下列物质所选试剂及对应分离方法均可行的是
正确答案
解析
略
知识点
除去下列物质中的杂质选用的试剂和方法最合理的是
正确答案
解析
略
知识点
饱和食盐水在化工生产和中学化学中有广泛应用,下列使用饱和食盐水的叙述错误的是
正确答案
解析
略
知识点
扫码查看完整答案与解析