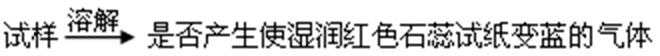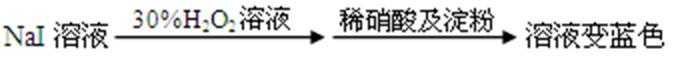- 蒸发和结晶、重结晶
- 共19题
利用右图实验装置,能得出相应实验结论的是
正确答案
解析
略
知识点
铵盐在工农业生产中有着重要的用途,请根据要求完成下列各题。
(1)某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。
1)仪器连接的顺序(用接口序号字母表示)是:a_________。
2)试从电离平衡角度分析该实验装置A中能产生氨气的原因:_________。
3)将装置C中两种液体分离开的操作名称是_________。
4)(NH4)2SO4“低毒,有刺激性,有吸湿性、吸湿后固结成块”。储存应注意_________。
(2)为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为_________。
(2)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,二是_________。
(3)由MgCl2溶液蒸发得到MgCl2·6H2O晶体,蒸发的目的是_________。
a.得到热饱和溶液
b.析出晶体
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:_________。
②由MgCl2·6H2O制备无水MgCl2的操作在_________氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
正确答案
(1)1)def;2)氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡NH3+H2O 
(2)1)Mg(OH)2+NH4Cl
解析
略。
知识点
4,7-二甲基香豆素(熔点:132.6℃)是一种重要的香料,广泛分布于植物界中,由间甲苯酚为原料的合成反应如下:
实验装置图如下:
主要实验步骤:
步骤1.向装置a中加入60mL浓硫酸,并冷却至0℃以下,搅拌下滴入间甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物。
步骤2.保持在10℃下,搅拌12h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗产品
步骤3.粗产品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0g。
(1)图中仪品名称:a ,c 。
(2)简述装置b中将活塞上下部分连通的目的 。
(3)浓H2SO4需要冷却至0℃以下的原因是 。
(4)反应需要搅拌12h,其原因是 。
(5)确定最终产品是4,7-二甲基香豆素的实
(6)本次实验产率为 。
正确答案
(1)三颈烧瓶;布氏漏斗
(2)平衡上下气压,使漏斗中液体顺利流下。
(3)防止浓硫酸将有机物氧化和炭化。
(4)使反应物充分接触反应,提高反应产率
(5)测量熔点或测定其红外(紫外)光谱(及核磁共振氢谱)等。
(6)90.3%。
解析
略
知识点
乙酰水杨酸俗称阿司匹林(
制备基本操作流程如下:
主要试剂和产品的物理常数如下表:
回答下列问题:
(1)合成阿司匹林时,最合适的加热方法是 。
(2)合成阿司匹林时,必须使用干燥的仪器,其原因是 。
(3)减压过滤所得粗产品要用少量冰水洗涤,其目的是 。

①沸石的作用是 ;
②冷凝水的流进方向是 (填“a”或“b”);
③使用温度计的目的是 。
(5)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(
最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为 (百分数精确到0.1)。
正确答案
(1)水浴加热(2分)
(2)
(3)
(4)
(5)
解析
略
知识点
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作所用的玻璃仪器是____ 。
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、______________________________。
(2)步骤④的离子方程式是 ___________________________________ 。
(3)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及 _______ 。
(4)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为 ______ 。
(5)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因 _______ 。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示) —————————— 。
正确答案
(1)玻璃棒、漏斗、烧杯 降温结晶
(2)Fe2++2HCO3—→FeCO3↓+H2O+CO2↑
(3)防止Fe2+被氧化
(4)1: 4
(5)FeCO3(s) 
(6)13.9/a
解析
略
知识点
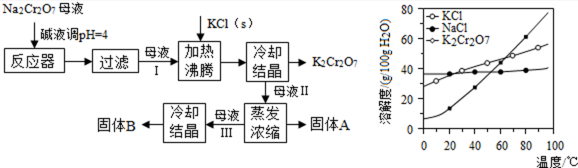
工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7),工艺流程及相关物质溶解度曲线如图:
(1)由Na2Cr2O7生产K2Cr2O7的化学方程式为________, 通过冷却结晶析出大量K2Cr2O7的原因是________。
(2)向Na2Cr2O7母液中加碱液调pH的目的是________。
(3)固体A主要为________(填化学式),固体B主要为________(填化学式)。
(4)用热水洗涤固体A,回收的洗涤液转移到母液________(填“Ⅰ”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗最低。
正确答案
(1)Na2Cr2O7+2KCl═K2Cr2O7+2NaCl;低温下K2Cr2O7的溶解度远小于其它组分,随温度的降低,K2Cr2O7的溶解度明显减小;(合理即得分)
(2)除去Fe3+;
(3)NaCl;K2Cr2O7;
(4)Ⅱ
解析
略。
知识点
废旧铅蓄电池的回收利用是发展循环经济的必经之路。其阴、阳极填充物(铅膏,主要含PbO、PbO2、PbSO4)是废旧铅蓄电池的主要部分,回收时所得黄丹(PbO)、碳酸铅可用于合成三盐基硫酸铅(组成可表示为3PbO·PbSO4·H2O),其工艺流程如下:
(1)用碳酸盐作转化剂,将铅膏中的硫酸铅转化为碳酸铅,写出转化反应方程式:
(2)滤液A能用来回收Na2SO4·10H2O,提取该晶体的主要步骤有____________、___________、过滤、洗涤、干燥;检验该晶体中阴离子的实验方法是________ ____。
(3)物质X是一种可循环使用的物质,其溶质主要是______________(填化学式),若X中残留的 
(4)生成三盐基硫酸铅的离子方程式为____________________。
(5)向铅膏浆液中加入Na2SO3溶液的目的是将其中的PbO2还原为PbO。若实验中所取铅膏的质量为47。8g,其中PbO2的质量分数为15%,则要将PbO2全部还原,至少需要加入______mL的0.5 mol/LNa2SO3溶液。
正确答案
(1)PbSO4(s)+


(2)蒸发浓缩 、冷却结晶 (2分) 取少量晶体溶于蒸馏水,然后用盐酸酸化,再滴BaCl2溶液,若出现白色沉淀,即证明该晶体中含有SO42- (2分)
(3)HNO3(2分) 浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率(2分)
(4)4 PbSO4 + 6OH- =3 PbO•PbSO4•H2O + 3 SO42- + 2 H2O (3分)
(5) 60(3分)
解析
略
知识点
下列说法正确的是
正确答案
解析
选项A中不仅锌比铁要活泼,而且会形成锌-铁-硫酸原电池,其反应速率较大,当锌消耗完后,反应速率自然会下降,故选项A正确。选项B中得到的是氯酸钾溶液,与硝酸银不会形成白色沉淀,必须先加亚硝酸钠将氯酸钾还原为氯化钾以后才可以用硝酸银检验氯离子的存在;选项C中,若浓缩至有大量晶体析出时,硫酸亚铁铵晶体会失水或分解;选项D中,如果是受浓硫酸腐蚀,应先用干布拭去再作相应处理。
知识点
下列实验设计能够成功的是
正确答案
解析
略。
知识点
用下列有关实验装置进行的相应实验中,能达到实验目的的是
图1 图2 图3 图4
正确答案
解析
略
知识点
扫码查看完整答案与解析