- 元素周期律的实质
- 共71题
14. X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是
正确答案
解析
X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y+和Z-具有相同的电子层结构,则Y在Z的下一周期,则Y为Na元素,Z为F元素,X、Y同周期,则X为S元素,
A.X、Y、Z分别为S、Na、F,原子最外层电子数分别为6、1、7,即原子最外层电子数:Z>X>Y,故A错误;
B.常温下Na、S为固体,F2为气体,Na的熔点较低,但钠的沸点高于硫,顺序应为Na>S>F2,故B错误;
C.Na+、F-具有相同的核外电子排布,离子的核电荷数越大,半径越小,应为F->Na+,S2-电子层最多,离子半径最大,故离子半径S2->F->Na+,故C错误;
D.电子层数越大原子半径越大,电子层数相同,原子序数越大半径越小,则原子半径:Y>X>Z,故D正确
考查方向
原子结构与元素周期律的关系
解题思路
X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y+和Z-具有相同的电子层结构,则Y在Z的下一周期,则Y为Na元素,Z为F元素,X、Y同周期,则X为S元素,结合元素在周期表中的位置以及元素周期律知识解答该题
易错点
B项中单质沸点的比较
教师点评
本题考查原子结构与元素周期律的关系,侧重于学生的分析能力的考查,题目难度不大,本题的关键是根据原子结构特点正确推断元素的种类。
知识点
12.X、Y、Z、W是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的金属性最强,W原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述正确的是( )
正确答案
解析
A.X.Y的氢化物分别为CH4.H2O,CH4的沸点在同族氢化物中最低,故A错误;
B.X.Y.Z分别是C.O.Na元素,含有三种元素的化合物有碳酸钠.醋酸钠.甲酸钠.醋酸钠等,故B正确;
C.同周期自左而右原子半径减小.同主族自上而下原子半径增大,一般电子层越多原子半径越大,故原子半径r(Na)>r(Cl)>r(C)>r(O),即原子半径r(Z)>r(W)>r(X)>r(Y),故C错误;
D.Y(O)与Z(Na)形成氧化钠.过氧化钠,过氧化钠含有共价键,Y(O)或W(Cl)形成的化合物含有共价键,故D错误.
故选:B.
考查方向
解题思路
X.Y.Z.W是短周期主族元素,X原子最外层电子数是次外层的两倍,最外层电子数不超过8个,则其K层为次外层,最外层电子数为4,则X是C元素;Y元素在地壳中的含量最多,则Y是O元素;Z元素的金属性最强,则Z是Na元素;W原子的核外电子数是X原子与Z原子的核外电子数之和,则W的核外电子数是17,所以W是Cl元素,据此解答.
知识点
15.如表所示的五种元素中,W.X.Y.Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是
正确答案
解析
W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y处于第二周期,W、Z处于第三周期,令W的最外层电子数为a,则X、Y、Z最外层电子数分别为a+1、a+2、a+3,故a+a+1+a+2+a+3=22,解得a=4,故W为Si、X为N、Y为O、Z为Cl、T为Ge.
A.Ge元素的单质具有半导体的特性,与Cl元素可形成化合物GeCl4,故A正确;
B.物质SiO2、Si3N4均为原子晶体,均有熔点高、硬度大的特性,而SiCl4为分子晶体不具有,故B错误;
C.N、O和H形成的化合物硝酸铵中既有离子键、又有共价键,故C错误;
D.X、Y、Z三种元素最低价氢化物分别为氨气、水、HCl,常温下水为液态,氨气、HCl为气体,故水的沸点最高,氨气分子之间都存在氢键,沸点比HCl的高,故D错误;
考查方向
原子结构与元素周期律的关系
解题思路
W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y处于第二周期,W、Z处于第三周期,令W的最外层电子数为a,则X、Y、Z最外层电子数分别为a+1、a+2、a+3,故a+a+1+a+2+a+3=22,解得a=4,故W为Si、X为N、Y为O、Z为Cl、T为Ge,以此来解答
易错点
氢键存在影响熔沸点
教师点评
本题考查原子结构与元素周期律的关系,为高频考点,把握短周期及最外层电子数的关系推断元素为解答的关键,涉及氢键、化学键、晶体类型及性质、元素周期律等,综合性较强,充分考查了学生灵活应用基础知识的能力,题目难度中等
知识点
6.X、Y、Z、W是元素周期表中短周期元素,四种元素在元素周期表中的位置关系如下图。如果它们都属于中学化学重点研究的对象,则下列说法中不正确的是
正确答案
解析
X、Y、Z、W是元素周期表中短周期元素,由四种元素在周期表中的相对位置,可知X和Y处于第二周期、Z和W处于第三周期,它们都属于中学化学重点研究的对象,说明均为主族元素,X、Y、Z、W应分别为C、N、S、Cl.
A.均形成分子晶体,相对分子质量越大,分子间作用力越强,沸点越高,故A正确;
B.同周期自左而右非金属性增强,氯元素非金属性比硫的强,故氯气的氧化性比硫的强,故B正确;
C.Y和W可以同时存在于同一离子化合物中,如NH4Cl等,故C正确;
D.碳元素可以形成多种气态氢化物,如甲烷、正丁烷、异丁烷等,故D错误
考查方向
位置结构性质应用
解题思路
X、Y、Z、W是元素周期表中短周期元素,由四种元素在周期表中的相对位置,可知X和Y处于第二周期、Z和W处于第三周期,它们都属于中学化学重点研究的对象,说明均为主族元素,X、Y、Z、W应分别为C、N、S、Cl.
A.均形成分子晶体,相对分子质量越大,沸点越高;
B.同周期自左而右非金属性增强,单质的氧化性增强;
C.Y和W可以同时存在于同一离子化合物中,如NH4Cl等;
D.碳元素可以形成多种气态氢化物.
易错点
C项:符合条件的物质举例
教师点评
本题考查位置结构性质应用,熟练掌握元素周期表的结构,题目难度不大
知识点
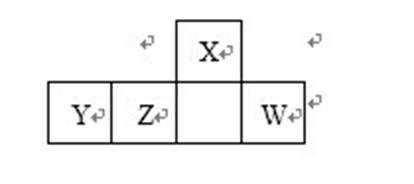
4. 短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Y所处的周期数和族序数相等,下列判断错误的是
正确答案
解析
短周期元素X、Y、Z、W在周期表中的位置如图所示,结合元素周期表结构可知,X处于第二周期,Y、Z、W处于第三周期;Y所处的周期数和族序数相等,则Y处于ⅢA族,为Al元素;结合各元素的相对位置可知,Z为Si、X为N、W为S元素,
A.Z为Si、X为N,非金属性:N>Si,则最简单气态氢化物的热稳定性:X>Z,故A正确;
B.Z为Si、W为S元素,非金属性:Si<S,最高价氧化物对应水化物的酸性:Z<W,故B正确;
C.电子层越多,原子半径越大,电子层相同时核电荷数越大,原子半径越小,则原子半径大小为:Y>Z>X,故C正确;
D.Y为Al元素,偏铝酸钠为Al的盐溶液,但偏铝酸钠呈碱性,故D错误
考查方向
原子结构与元素周期律
解题思路
短周期元素X、Y、Z、W在周期表中的位置如图所示,结合元素周期表结构可知,X处于第二周期,Y、Z、W处于第三周期;Y所处的周期数和族序数相等,则Y处于ⅢA族,为Al元素;结合各元素的相对位置可知,Z为Si、X为N、W为S元素,结合元素周期律的知识进行判断
易错点
C项:原子半径比较
教师点评
本题考查了原子结构与元素周期律的关系,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,题目难度不大
知识点
扫码查看完整答案与解析