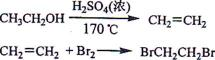- 溴乙烷的制取
- 共3题
实验室制备1,2-二溴乙烷的反应原理如下:
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
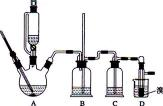
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
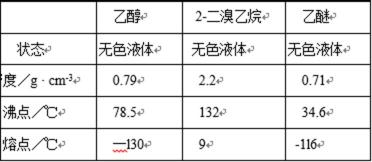
有关数据列表如下:
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应
b.加快反应速度
c.防止乙醇挥发
d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a,水
b,浓硫酸
c,氢氧化钠溶液
d,饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a,水
b,氢氧化钠溶液
c,碘化钠溶液
d,乙醇
(6)若产物中有少量副产物乙醚,可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
正确答案
(1)d
(2)c
(2)溴的颜色完全褪去
(4)下
(5)b
(6)蒸馏
(7)避免溴大量挥发;产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管。
解析
(1)因“乙醇在浓硫酸的存在下在l40℃脱水生成乙醚”,故迅速地把反应温度提高到170℃左右的原因是减少副产物乙醚生成。
(2)因装置C的“目的是吸收反应中可能生成的酸性气体”,故应选碱性的氢氧化钠溶液。
(3)是用“少量的溴和足量的乙醇制备1,2—二溴乙烷”,反应结束时溴已经反应完,明显的现象是溴的颜色褪尽。
(4)由表中数据可知,1,2-二溴乙烷的密度大于水,因而在下层。
(5) Br2能与氢氧化钠溶液反应,故可用氢氧化钠溶液洗涤;虽然也能与碘化钠溶液反应,但生成的I2也溶于1,2-二溴乙烷。
(6)根据表中数据,乙醚沸点低,可通过蒸馏除去(不能用蒸发,乙醚不能散发到空气中)。
(7)溴易挥发,冷水可减少挥发。但如果用冰水冷却会使产品凝固而堵塞导管。
知识点
实验室制取少量溴乙烷的装置如图所示。根据题意完成下列填空:
(1)圆底烧瓶中加入的反应物是溴化钠、________和1:1的硫酸。配制体积比1:1的硫酸所用的定量仪器为________(选填编号)。
a. 天平
b. 量筒
c. 容量瓶
d. 滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式________。
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是________。
试管A中的物质分为三层(如图所示),产物在第________层。
(4)试管A中除了产物和水之外,还可能存在________、________(写出化学式)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是________(选填编号)。
a. 蒸馏
b. 氢氧化钠溶液洗涤
c. 用四氯化碳萃取
d. 用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是________。
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:________。
正确答案
(1)乙醇;b
(2)NaBr+H2SO4

(3)冷却、液封溴乙烷;3
(4)HBr;CH3CH2OH
(5)d;乙烯
(6)反应会产生Br2,腐蚀橡胶
解析
本题主要考察溴乙烷的制备、提纯、有机反应等复杂性以及实验安全等。
(1)(2)实验室制取少量溴乙烷所用试剂是乙醇和溴化氢反应;溴化氢可利用溴化钠和硫酸反应制得。配制一定体积比的硫酸使用量筒即可,因为该浓度不是物质的量浓度并且不需要非常精确,因此不需要使用滴定管。
(3)(4)溴乙烷的密度比水大且不溶于水,冰水混合物的作用是冷却、液封溴乙烷,第三层为溴乙烷,最上层有可能是副反应产生的乙醚等杂质、第二层是挥发的HBr、乙醇等的水溶液。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,说明含有溴单质,由于溴乙烷与溴均易挥发,且均易溶于有机物,因此不能使用蒸馏或萃取的方法,二者均能与氢氧化钠溶液反应,不也不能使用氢氧化钠洗涤,用亚硫酸钠可将溴进行还原从而进行洗涤。
(6)生成的溴会腐蚀橡胶。
知识点
某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物制备溴乙烷,检验反应的部分副产物,并探究溴乙烷的性质。
(一) 溴乙烷的制备及产物的检验:设计了如图一装置,其中夹持仪器、加热仪器及冷却水管略去。请根据实验步骤,回答下列问题:
(1)仪器E的作用是________________ ,
(2)制备操作中,加入少量水,其目的是_______(填字母)。
a.减少副产物烯和醚的生成
b.减少Br2的生成
c.减少HBr的挥发
d.水是反应的催化剂
(3)加热片刻后,A中的混合物出现橙红色,该橙红色物质可能是____________
(4)理论上,上述反应的副产物还可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、溴化氢等
① 检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直E上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验。B、C中应盛放的试剂分别是________、__________
② 检验副产物中是否含有乙醚:某同学通过红外光谱仪鉴定所得产物中含有“-CH2CH3”基团,确定副产物中存在乙醚。请你对该同学的观点进行评价:_________________。
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是____________。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(二)溴乙烷性质的探究:
用图二实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
Ⅰ:在试管中加入10 mL6mol/L NaOH溶液和2 mL 溴乙烷,振荡。
II:将试管如图固定后,水浴加热。
(6)观察到________现象时,表明溴乙烷与NaOH溶液已完全反应。
(7)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图三装置。
A试管中的水的作用是______,无A试管,B试管中的试剂应为______________。
正确答案
(1)冷凝、回流
(2)abc
(3)Br2
(4)①苯(或四氯化碳等有机溶剂)、硝酸银或石蕊试液
②不正确;溴乙烷中也含乙基
(5)c
(6)液体不分层(均匀溶液)
(7)吸收乙醇(HBr);溴水
解析
略
知识点
扫码查看完整答案与解析