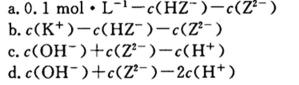- 盐类水解的应用
- 共21题
下列有关实验装置进行的相应实验,能达到实验目的的是
正确答案
解析
本题属于基础实验与基本实验操作的考查范畴。
A图1所示装置中氢氧化钠会与Cl2反应。
B NH4Cl晶体受热分解,会“假升华”。
C纯碱是可溶性固体,不能用此装置,改在圆底烧瓶和分液漏斗的组合中进行。
D用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层,有机层从下口放出,水层从上口倒出,实现分液。
本题以常见气体制取、蒸干、除杂、萃取、分液为实验操作为素材,考查学生对实验操作的熟悉程度和实验原理的应用能力,试图引导中学化学教学关注化学实验操作的真实性。
知识点
常温下,浓度均为0.1 mol/L的6种溶液pH如下:
请由上表数据回答:
(1)非金属性Si C(填“>”或“<”),用原子结构解释其原因:同主族元素由上到下 。
(2)常温下,相同物质的量浓度的下列稀溶液,其酸性由强到弱的顺序是(填序号) 。
a.H2SiO3
b.H2SO3
c.H2CO3
(3)用离子方程式说明Na2CO3溶液pH>7的原因 。
(4)6种溶液中,水的电离程度最小的是(填化学式) 。
(5)若增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是(填化学式) ,
用化学平衡移动的原理解释其原因: 。
正确答案
见解析。
解析
(1)< 原子半径逐渐增大,得电子能力逐渐减弱
(2)bca
(3)CO32-+H2O
(4)NaHSO3
(5)NaHCO3(或NaClO) 因为Cl2 + H2O
知识点
向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2CO3、CH3COONa固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为
正确答案
解析
略
知识点
25℃时,满足

正确答案
解析
略。
知识点
将足量CO2通入KOH和Ca(OH)2混合溶液,生成沉淀的物质的量和通入CO2体积(V)的关系正确的是
正确答案
解析
略
知识点
下列判断正确的是
正确答案
解析
略
知识点
根据下列操作及现象,所得结论正确的是
正确答案
解析
略
知识点
23.25℃时,某浓度的NH4Cl溶液pH = 4,下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
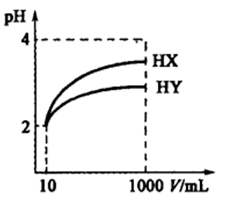
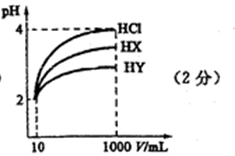
28.常温下,10 mL pH均为2的HX、HY两种一元酸溶液加水稀释过程中溶液的pH随溶液体积变化曲线如右图所示:
请回答下列问题:
(1)在图中用曲线表示将10 mL pH=2的盐酸加水稀释到1000 mL的过程中溶液pH变化趋势。
(2)物质的量浓度均为
(3)常温下,
(4)若HX、HY均为非氧化性酸,在上述稀释后的HX、HY和盐酸三种溶液中加入足量相同规格的铁粉,则产生氢气的速率最快的是 ( ),产生氢气体积最少的是 ( )。
(5)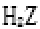

正确答案
(1)
(2)
(3)
(4)
(5)
解析
解析已在路上飞奔,马上就到!
知识点
6.下列过程或现象与盐类水解无关的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析