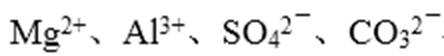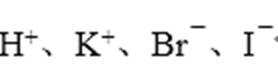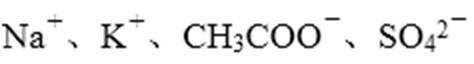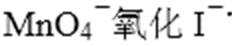- 离子共存问题
- 共125题
3.室温下,下列各组离子在指定溶液中一定不能大量共存的是
正确答案
解析
A.H+、Na+、SO42-、Cu2+之间不发生发反应,所以可以共存,A错误;
B.Kw/c(OH-)=1 mol·L-1的溶液为酸性溶液,CO32-在酸性溶液中不能共存,B正确;
C.NaHSO4溶液为酸性溶液,NO3-在酸性条件下和Fe3+都具有氧化性,在溶液中能大量共存,故C错误;
D.能使甲基橙显黄色的溶液可能呈酸性、中性或者碱性,Ca2+、Ba2+、Br-、C1-在酸性、中性或者碱性都不发生化学反应,可以共存,所以D错误。
考查方向
解题思路
A.H+、Na+、SO42-、Cu2+之间不发生发反应;
B.Kw/c(OH-)=1 mol·L-1的溶液为酸性溶液,
C.在0.1 mol·L-1NaHSO4溶液为酸性;
D.能使甲基橙显黄色的溶液可能呈酸性、中性或者碱性;
易错点
不能有效判断习题中的隐含信息,忽略离子之间的氧化还原反应。
知识点
12.常温下,下列各组离子一定能在指定溶液中大量共存的是
正确答案
解析
A.是的酚酞变红的溶液为碱性,因此溶液中存在大量的OH-,Al3+不能大量共存;
B.
C.与Al反应能放出H2的溶液可能是强酸性或者强碱性溶液,如果是强碱性溶液则Fe2+不能大量共存,如果是强酸性溶液,溶液中存在NO3﹣会具有强氧化性,与Al反应生成氮的氧化物;
D.水电离的c(H+)=1×10﹣13mol•L﹣1的溶液可见水的电离是被抑制,因此溶液为强酸性或强碱性,若为强酸性AlO2﹣、CO32﹣不能大量共存
考查方向
解题思路
离子共存需要考虑离子反应条件、溶液的酸碱性、双水解、氧化还原、常见强氧化性离子与常见还原性的离子
易错点
离子反应条件不清、溶液酸碱性与PH的关系,KW的意义
知识点
8.常温下,下列各组离子在指定溶液中,一定可以大量共存的是
正确答案
解析
A 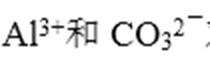
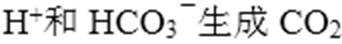
考查方向
解题思路
无色代表无铜离子这样的有色离子,PH=1代表氢离子参与共存
易错点
易忽略题目中所给的酸碱等环境因素
知识点
2.下列说法不正确的是()
正确答案
解析
Na+、SO42-、Fe3+、MnO4-之间不反应,在溶液中可以大量共存,故A正确;
晶体中HSO4-不电离,故只有0.1mol阳离子,即K+,因此阳离子所带电荷数为NA ,故B正确;
235U和238U质子数相同、中子数不同,互为同位素,化学性质基本相同,235U转化成238U是核反应,不属于化学变化,故C正确;
元素O、S、P的气态氢化物热稳定性依据非金属性判断,应该以此递减,故D错误。
考查方向
解题思路
A:Na+、SO42-、Fe3+、MnO4-之间不反应,在溶液中可以大量共存;
B:晶体中HSO4-不电离,故只有0.1mol阳离子,即K+,因此阳离子所带电荷数为NA;
C:235U和238U互为同位素,化学性质基本相同,235U转化成238U是核反应,不属于化学变化;
D:元素O、S、P的气态氢化物热稳定性依据非金属性判断,应该以此递减。
易错点
忽略离子共存的溶液条件;对阿伏伽德罗理解不透彻,对同位素及元素周期律概念混淆;
知识点
5.常温下,下列各组离子在指定溶液中一定能大量共存的是
正确答案
解析
A.硝酸将Fe2+氧化为Fe3,H+、Fe2+、NO3-不能共存,故A错误
B. c(OH-)=10-2 mol·L-1,呈碱性,能大量共存,故B正确
C. 酸性条件,Ag(NH3)2-和Cl-、SO42-反应生成沉淀,不能大量共存,故C错误
D. ClO-能氧化SO32-、S2-,不能大量共存,故D错误
故本题选择B
考查方向
解题思路
A.硝酸将Fe2+氧化为Fe3,H+、Fe2+、NO3-不能共存
B. c(OH-)=10-2 mol·L-1,呈碱性,能大量共存;
C. 酸性条件,Ag(NH3)2-和Cl-、SO42-反应生成沉淀,不能大量共存
D. ClO-能氧化SO32-、S2-,不能大量共存。
易错点
不会根据c(H+)/c(OH-)=10-10判断溶液的酸碱性
知识点
扫码查看完整答案与解析