- 铝的化学性质
- 共25题
用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为________;Al与NaOH溶液反应的离子方程式为________________________________________________________________________。
(2)30Si原子的中子数为________;SiO2的晶体类型为____________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族元素的氢化物中沸点最低的是________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为________。
正确答案
(1) 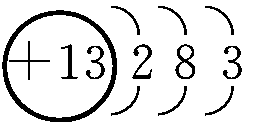
(2)16;原子晶体
(3)HCl
(4)CO2
(5)25%
解析
本题考查元素化合物的性质及物质结构与性质。
(1)铝的原子结构示意图为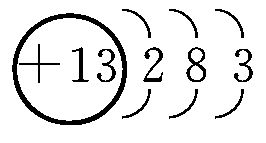
(2)中子数等于质量数减去质子数,因此30Si的中子数为16,二氧化硅为原子晶体;
(3) 由Y所在的族各元素的氢化物的水溶液均显酸性,则Y位于第ⅦA族,Y为氟元素,该族元素的氢化物均为分子晶体,相对分子质量越大,沸点越高,但HF分子间存在氢键,沸点较HCl高,故沸点最低的为HCl;
(4)根据药皮的成分确定焊接过程中产生的气体为二氧化碳;
(5)加入足量稀盐酸,分离得到的固体为SiO2,即m(SiO2)=11.0g,21.4 g固体为氢氧化铁,其物质的量为=0.2 mol,由铁原子守恒可确定n(Fe2O3)=0.1 mol,m(Fe2O3)=16.0 g,进而求出 m(Al2O3)=9.0 g,ω(Al2O3)=×100%=25%。
知识点
下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是
正确答案
解析
略
知识点
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。完成下列填空:
(1)铝原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子。
(2)镓(Ga)与铝同族。写出镓的氯化物和氨水反应的化学方程式。
(3)硅与铝同周期。SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 。
长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为
(4)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
2Al+4BaO
常温下Al的金属性比Ba的金属性 (选填“强”“弱”)。利用上述方法可制取Ba的主要原因是 。
A.高温时Al的活泼性大于Ba
B.高温有利于BaO分解
C.高温时BaO·Al2O3比Al2O3稳定
D.Ba的沸点比Al的低
正确答案
(1)4,13。
(2)
(3)
(4)弱,d
解析
(1)铝原子核外电子云有s、p,分别有1、3种伸展方向,其核外有13个电子,则有13种不同运动状态;
(2)类似氯化铝与氢氧化钠溶液反应;
(3)根据不同类长石其氧原子的物质的量分数相同,结合化合价代数和是0可写出钙长石的化学式;
(4)该反应是利用Ba的沸点比Al的低,Ba气化逸出,使平衡右移。
知识点
下列有关实验操作、现象和解释或结论都正确的是
正确答案
解析
本题综合考查化学实验以及元素化合物的相关知识。
A选项,铁粉过量应该生成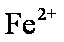
知识点
足量下列物质与等质量的铝反应,放出氢气且消耗溶质物质的量最少的是
正确答案
解析
首先硝酸与金属铝反应不生成氢气,根据生成物的化学式:Na[Al(OH)4]、Al2(SO4)3、AlCl3,通过物料守恒可直接判断出等量的铝消耗NaOH物质的量最少。
知识点
扫码查看完整答案与解析
