- 铝的化学性质
- 共25题
9.铝自然形成的氧化膜易脱落。以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强。其制备的简要流程如下图。下列用来解释流程中反应的方程式不正确的是( )
正确答案
解析
A.由于铝材表面有一层致密的氧化膜Al2O3,所以要通过强碱除去铝材表面的自然氧化膜;氧化铝为两性氧化物,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,反应的离子方程式为:2OH- + Al2O3 === 2AlO2- + H2O;
B.碱洗时铝材中的单质铝会与强碱发生反应,有H2产生,所以铝材表面会出现气泡,反应的离子方程式为:2Al + 2OH- + 2H2O === 2AlO2- + 3H2↑;
C.铝材的作阳极,在酸性电极反应为:4Al – 12e- + 6H2O=== 2Al2O3+ 12H+
D.由于氨水为弱酸,所以洗去耐蚀铝材表面的酸时,只与硫酸反应,不与形成的氧化膜以及单质铝反应,反应的离子方程式为:NH3·H2O + H+ === NH4+ + H2O
考查方向
通过电解处理形成的氧化铝膜的过程考查单质铝及其化合物知识,进一步考查离子反应及电极反应方程式的书写和判断。
解题思路
判断离子方程式正确与否的方法一般是:
(1)检查反应能否发生。
(2)检查反应物、生成物是否正确。
(3)检查各物质拆分是否正确。
(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。
(5)检查是否符合原化学方程式,据此可以分析。
A.由于铝材表面有一层致密的氧化膜Al2O3,所以要通过强碱除去铝材表面的自然氧化膜;氧化铝为两性氧化物,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
B.碱洗时铝材中的单质铝会与强碱发生反应,有H2产生,所以铝材表面会出现气泡:
C.铝材的作阳极,在酸性电极反应为:4Al – 12e- + 6H2O=== 2Al2O3+ 12H+
D.由于氨水为弱酸,所以洗去耐蚀铝材表面的酸时,只与硫酸反应,不与形成的氧化膜以及单质铝反应。
易错点
不能正确判断及书写电极反应:电极反应也属于离子反应,要遵循电荷守恒规律。
知识点
某溶液中,可能含有下表所列离子中的某几种: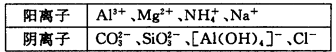
21.若X是NaOH溶液,原溶液中一定含有的阴离子有_________________;BC段反应的离子方程式为______________。
22.若X是盐酸,则原溶液中一定含有的金属阳离子是____________;AB段发生反应的总离子方程式为____________;OA段生成沉淀的物质的量之比为________________。
正确答案
Cl- Al(OH)3+OH-=[Al(OH)4] -或Al(OH)3+OH- = AlO2+ H2O
解析
加入盐酸后能形成的沉淀有Al(OH)3、H2SiO3,前者能溶于过量盐酸而后者不能,由图像知溶液中肯定含有AlO2-、SiO32-,Oa段发生反应的离子为AlO2-、SiO32-,ab段发生反应的离子为CO32-,bc段则是Al(OH)3溶解。当向溶液中加入NaOH溶液时,生成的沉淀为Mg(OH)2、Al(OH)3,ab段是NH4+与OH-发生反应,因Mg2+、Al3+不能与CO32-、SiO32-、AlO2-共存,故此时溶液中的阴离子只有Cl-。
考查方向
解题思路
根据离子反应发生条件以及沉淀生成的顺序,熟练应用元素及其化合物的性质。
易错点
离子反应发生条件
正确答案
Na+ CO32-+2H+=H2O+CO2↑ n(H2SiO3)∶n[Al(OH)3]= 11∶2
解析
加入盐酸后能形成的沉淀有Al(OH)3、H2SiO3,前者能溶于过量盐酸而后者不能,由图像知溶液中肯定含有AlO2-、SiO32-,Oa段发生反应的离子为AlO2-、SiO32-,ab段发生反应的离子为CO32-,bc段则是Al(OH)3溶解。当向溶液中加入NaOH溶液时,生成的沉淀为Mg(OH)2、Al(OH)3,ab段是NH4+与OH-发生反应,因Mg2+、Al3+不能与CO32-、SiO32-、AlO2-共存,故此时溶液中的阴离子只有Cl-。
考查方向
解题思路
根据离子反应发生条件以及沉淀生成的顺序,熟练应用元素及其化合物的性质。
易错点
离子反应发生条件
6.钨酸盐多用作功能材料,也可用作陶瓷材料、催化剂、颜料、防腐剂和防火剂等。在新材料制造中有重要应用,GeWO4的制备方法如下:2GeO (g) +W2O6 (g) 
正确答案
解析
A.△G=△H-T△S,△S<0,温度越高,△G越大,不利于反应的自发进行,A错误;
B.增加GeO的量,其转化率降低,B错误;
C.实际生产中为提高经济效益要尽可能地升高反应温度,加快化学反应速率,C错误;
D.当GeO (g)的消耗速率与 GeWO4 (g)的消耗速率相等时,正逆化学反应速率相等,反应到达平衡,D正确。
故选D。
考查方向
解题思路
A.△G=△H-T△S,△S<0,温度越高,△G越大;
B.增加GeO的量,其转化率降低;
C.实际生产中为提高经济效益要尽可能地升高反应温度,加快化学反应速率;
D.正逆化学反应速率相等,反应到达平衡。
易错点
本题考查了影响平衡移动的因素,注意利用勒夏特列原理分析,题目难度不大。
知识点
不属于国际上可自由兑换货币的是( )。
A.(A) 瑞士法郎
B.(B) 港币
C.(C) 越南盾
D.(D) 加拿大元
正确答案
C
解析
暂无解析
聚合氯化铝(PAC)是常用于水质净化的无机高分子混凝剂,其化学式可表示为[Al2(OH)nCl6-n]m (n < 6,m为聚合度) 。PAC常用高温活化后的高岭土(主要化学组成为Al2O3、SiO2、Fe2O3)进行制备,工艺流程如下图所示:
24.盐酸酸浸所涉及反应的离子方程式是
25.已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释加入X的主要目的: ,滤渣中主要含有物质的化学式是
26.已知:生成液体PAC的反应为2Al3+ + m(6-n) Cl- + mn H2O
27.浓缩聚合得到含PAC的液体中铝的各种形态主要包括:
图1为Al各形态百分数随温度变化的曲线;图2为含PAC的液体中铝的总浓度AlT随温度变化的曲线。
① 50-90℃之间制备的液体PAC中,_______形态铝含量最多。
② 当T > 80℃时,AlT明显降低的原因是_________。
正确答案
6H+ + Al2O3 === 2Al3+ + 3H2O 6H+ + Fe2O3 === 2Fe3+ + 3H2O
解析
导致液体PAC向Al(OH)3沉淀转化解析过程: 高岭土的主要化学组成为Al2O3、SiO2、Fe2O3,加入盐酸后,Al2O3与Fe2O3均会与其发生反应,则反应的离子方程式为6H+ + Al2O3 === 2Al3+ + 3H2O 6H+ + Fe2O3 === 2Fe3+ + 3H2O,故答案为6H+ + Al2O3 === 2Al3+ + 3H2O 6H+ + Fe2O3 === 2Fe3+ + 3H2O;
考查方向
本题主要考查了以聚合氯化铝晶体的制备为载体,考查铝及其化合物性质、离子方程式、对工艺流程的理解、除杂等,难度中等,关键在于对工艺流程的理解,和知识的迁移运用。
解题思路
铝灰主要含Al2O3、Al,还有SiO2等杂质,加入盐酸,氧化铝和铝能与盐酸反应,二氧化硅不能与盐酸反应。
易错点
1、工艺流程的理解。
2、调pH值促进沉淀。
正确答案
调节溶液pH至Fe3+完全沉淀 Fe(OH)3 、SiO2
解析
加入X的目的应是除去铁离子,调节溶液pH至Fe3+完全沉淀,滤渣中含有的物质应是Fe(OH)3 、SiO2,故答案为Fe(OH)3 、SiO2;
考查方向
本题主要考查了以聚合氯化铝晶体的制备为载体,考查铝及其化合物性质、离子方程式、对工艺流程的理解、除杂等,难度中等,关键在于对工艺流程的理解,和知识的迁移运用。
解题思路
工艺流程为:铝灰与过量的盐酸反应,过滤后收集滤液,加热浓缩至饱和,调pH值,稍静置,过滤收集滤渣.最终的这个滤渣就是我们要的晶体。
易错点
1、工艺流程的理解。
2、调pH值促进沉淀。
正确答案
pH偏小时,抑制平衡2Al3+ + m(6-n) Cl- + mn H2O
解析
pH偏小时,c(H+)增大, 2Al3+ + m(6-n) Cl- + mn H2O

考查方向
解题思路
溶液调pH值,促进Fe3+完全沉淀。
易错点
1、工艺流程的理解。
2、调pH值促进沉淀。
正确答案
① 聚合 ② 温度升高
解析
①由图可观察到,温度在50-90℃之间时,聚合形态铝的含量较多;② 当T > 80℃时,由图1可知,氢氧化铝胶体增大,聚合形态铝减小,则AlT明显降低的原因是温度升高,导致液体PAC向

考查方向
本题主要考查了以聚合氯化铝晶体的制备为载体,考查铝及其化合物性质、离子方程式、对工艺流程的理解、除杂等,难度中等,关键在于对工艺流程的理解,和知识的迁移运用。
易错点
1、工艺流程的理解。
2、调pH值促进沉淀。
扫码查看完整答案与解析