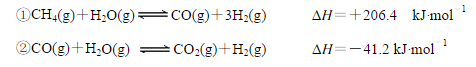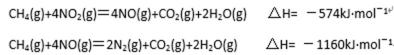- 化学研究方法与工业化学
- 共64题
9.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
正确答案
知识点
14.在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。下列说法错误的是( )
正确答案
知识点
CO2是重要的化工原料,也是应用广发的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
50.CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00 mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
51. 某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
52.CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 mol O2,则反应前密封舱内H2O的量应该是多少?列式计算。
53.甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O
已知:CO+2H2

300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率。
正确答案
89.6
解析
碳酸氢铵完全分解再干燥后得氨气、二氧化碳,2.00 mol NH4HCO3完全分解,得2mol的氨气和2mol的CO2,即气体共4mol,标况下的体积为:89.6L。
考查方向
解题思路
物质的量应用于化学方程式的计算要注意步骤:1.正确的写出化学方程式。2.找到已知量和要求量之间的关系。3.列比例式,求解。化学计算中常常涉及的计算方法有守恒法和极值法,需要熟练掌握。
易错点
计算不细心。
正确答案
2.4 mol/L≥c≥1.2 mol/L
解析
该反应只是说完全反应,并没有说明生成什么,可能全部的碳酸钠,也可能全部是碳酸氢钠:
(1)CO2+NaOH=NaHCO3,n(NaOH)= n(CO2)=2.40mol,则c(NaOH)=
(2)CO2+2NaOH=Na2CO3,n(NaOH)=2n(CO2)=4.80mol,则c(NaOH)=
综合(1)、(2)可知,NaOH溶液的浓度应该1.20mol/L≤c(NaOH)≤2.40mol/L。
考查方向
解题思路
根据CO2与NaOH恰好反应,只需满足1/2≤n(CO2):n(NaOH) ≤1即可。
易错点
不知道符合1/2≤n(CO2):n(NaOH) ≤1,CO2与NaOH都是恰好反应。
正确答案

解析
法一:
依题意,9 mol CO2在密封舱内和KO2反应后生成9 mol O2,即n(CO2)∶n(O2)=1∶1,通过观察题给两个方程式可知,当把两个方程式相加时正好符合题目要求:
8KO2+6CO2+2H2O→2K2CO3+4KHCO3+6O2
所以有n(H2O)=

法二:
设反应前密封舱内H2O的物质的量为n
4KO2 + 4CO2 + 2H2O → 4KHCO3 + 3O2
2n n 1.5n
4KO2 + 2CO2 → 2K2CO3 + 3O2[来源:学科网ZXXK]
9-2n 1.5(9-2n)
根据题意生成氧气9mol,所以有1.5n+ 1.5(9-2n)=9mol,解得n=3mol,即反应前密封舱内
H2O的物质的量为3mol。
考查方向
解题思路
物质的量应用于化学方程式的计算要注意步骤:1.正确的写出化学方程式。2.找到已知量和要求量之间的关系。3.列比例式,求解。化学计算中常常涉及的计算方法有守恒法和极值法,需要熟练掌握。
易错点
比例式上下单位要一致。
正确答案
α=80/100=80%
解析
法一:
CH4 + H2O → CO + 3H2
300mol 300mol 900mol
设CO2的转化率为α,CO的转化率为β
CO + 2H2 → CH3OH CO2 + 3H2 → CH3OH + H2O
300βmol 600βmol 300βmol 100αmol 300αmol 100αmol
根据题意,共生成350mol甲醇,所以有300βmol+100αmol=350mol-------①式
根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol-350mol,所以有
600βmol+300αmol=900mol-350mol--------②式
由①②式可得α=0.8,即设CO2的转化率为80%。
法二:
在合成甲醇的反应中,氢元素在生成物中有两种存在形式,一是存在于甲醇中,二是存在于水中。利用守恒法也可求得答案。
考查方向
解题思路
物质的量应用于化学方程式的计算要注意步骤:1.正确的写出化学方程式。2.找到已知量和要求量之间的关系。3.列比例式,求解。化学计算中常常涉及的计算方法有守恒法和极值法,需要熟练掌握。
易错点
不能准确找到已知量和要求量之间的关系。
(一)污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是
A.氨水
B.硫化氢气体
C.硫酸钠溶液
D.纯碱溶液
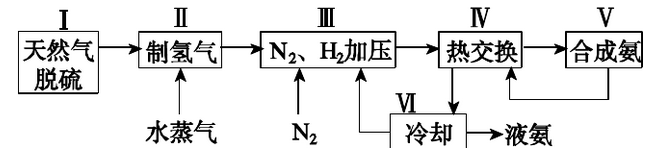
(二)合成氨的流程示意图如下:

(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 ,
;
(2)设备A中含有电加热器、触煤和热交换器,设备A的名称 ,其中发生的化学反应方程式为 ;
(3)设备B的名称 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。不宜从相反方向通水的原因
;
(4) 设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:
正确答案
解析
(一)加入氨水后,Cu2+会生成络合物,不能生成沉淀,故A错;硫酸钠与Cu2+也不会生成沉淀,故C错。H2S与三种离子会生成CuS、HgS和PbS沉淀;纯碱能增大溶液的pH,使三种离子都生成沉淀。
(二)(1)利用空气中氮气的沸点比氧气的沸点低,先将空气加压降温变成液态,然后再加热,使氮气首先从液态空气中蒸发出来,留下的就是液态氧气。故分离方法是液化和分馏。另一种方法是将空气与C反应后除去CO2。采用煤和天然气制备H2的方程式为:C+H2O

(2)合成氨的设备为合成塔;发生的反应是N2+3H2
(3)冷凝分离氨气的设备为冷却塔;为了增强冷却效果,冷却水应从下端进入,逆向冷却效果好。(4)设备c是分离器,能将液氨和未反应的原料分离。
(5)设CO、H2O的起始浓度分别为x、y,且CO的转化率为90%,则:
CO2(g)+H2(g)
起始浓度(mol·L-1) x y 0 0
转化浓度(mol·L-1) 0.9x 0.9x 0.9x 0.9x
平衡浓度(mol·L-1) 0.1x y-0.9x 0.9x 0.9x
K=
知识点
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)
一种工业合成氨的简易流程图如下:
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: 。
(2)步骤II中制氯气原理如下:
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 。
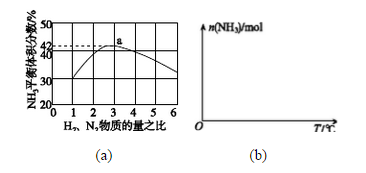
(3)图1表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数: 。
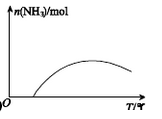
(4)依据温度对合成氨反应的影响,在图2坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,简述本流程中提高合成氨原料总转化率的方法: 。
正确答案
(1)
(2)a 90%
(3)14.5%
(4)
(5)Ⅳ
对原料气加压:分离液氨后,未反应的

解析
略
知识点
符合目前工业生产实际的化工生产原理是
正确答案
解析
略
知识点
下列化学工业有关设备,原料,反应条件配套的是
正确答案
解析
略
知识点
工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)
c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g)
(3)氨气在纯氧中燃烧生成一种单质和水,科学家利用此原理,设计成“氨气-氧气”燃料电池,则通入氨气的电极是__________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为_______________________。
(4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
则甲烷直接将NO2还原为N2的热化学方程式 为 。
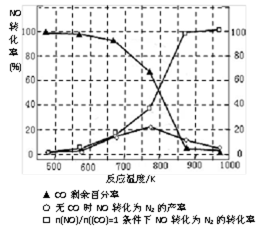
(5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如右图。据图分析,若不使用CO,温度超过775K发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在_______左右。
正确答案
(1)(2分)1 (2)(2分)<(写成“小于”扣1分)
(3)(4分)负极 (2分) 2NH3 — 6e- + 6OH- = N2 +6H2O (2分。化学式1分、配平1分)
(4)(3分)CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) △H=-867kJ/mol (方程式2分,
△H数值1分)
(5)(5分)该反应是放热反应(1分),当在775K反应达到平衡后继续升高温度(1分),平衡向逆(左)方向移动,NO转化率降低(1分) 870K(2分。写860-875K之间任意数值均给分)
解析
略
知识点
传统合成氨工业需要采用高温、高压和催化剂。近来美国化学家使用新型铁系催化剂,在常温下合成了氨气。下列说法正确的是 ( )
正确答案
解析
略
知识点
26.氯化铁是一种重要的化学试剂和化工原料,工业上以黄铁矿(主要成分为FeS2)为原料在制备硫酸的同时,利用其煅烧后炉渣的主要成分Fe2O3可制备氯化铁晶体(FeCl3·6H2O),其工艺流程如下(杂质不参与反应):
回答下列问题:
(1)高温煅烧时,黄铁矿要粉碎成细小的颗粒,其目的是 。
(2)黄铁矿高温煅烧时发生反应的化学方程式 。
(3)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(4)系列操作包括:蒸发浓缩、 、 、洗涤等。蒸发与过滤时玻璃棒的作用分别是: 、 。
(5)取a g黄铁矿,按上述流程制得FeCl3·6H2O晶体,将该晶体溶于水,再将所得溶液蒸干、灼烧,得到b g固体产物(整个过程中的损耗忽略不计),黄铁矿的纯度为 (用含a、b的表达式表示)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析