- 化学实验
- 共767题
下列说法不正确的是
正确答案
解析
由于量筒的精确度只到0.1ml,配出来的溶液只能精确到0.1mol/L,所以C不正确。这题属于实验化学,常识题。
知识点
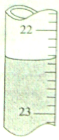
用0.1026mol·L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为
正确答案
解析
图中液面在22~23mL之间,分刻度有10个,因而每刻度是0.1mL,液体的凹面读数约为22.35mL。
知识点
K3[Fe(C2O4)3]·3H2O [三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应的化学方程式为:
Fe(s)+H2SO4=FeSO4+H2↑
FeSO4+H2C2O4+2H2O = FeC2O4·2H2O↓+H2SO4
2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
回答下列问题:
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是_______。
A.
B.
C.
D. 
(2)在得到的FeSO4溶液中需加入少量的H2SO4酸化,目的是_______;
在将Fe2+氧化的过程中,需控制溶液温度不高于40℃,理由是_______;
得到K3[Fe(C2O4)3]溶液后,加入乙醇的理由是_______。
(3)析出的K3[Fe(C2O4)3]晶体通过如下图所示装置的减压过滤与母液分离。下列操作不正确的是_______。
A. 选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸
B. 放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤
C. 洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再打开水龙头抽滤
D. 抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸
(4)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算。步骤③需要在干燥器中进行,理由是_______;步骤⑤的目的是_______。
(5)晶体中C2O42-含量的测定可用酸性KMnO4标准溶液滴定。滴定过程中发现,开始时滴入一滴KMnO4标准溶液,紫红色褪去很慢,滴入一定量后紫红色很快褪去,理由是_______。
(6)下列关于酸式滴定管的使用,正确的是_______。
A. 滴定管用蒸馏水洗涤后,即可装入标准溶液
B. 装入标准溶液后,把滴定管夹在滴定管夹上,轻轻转动活塞,放出少量酸液,使尖嘴充满酸液
C. 滴定管中溶液体积应读数至小数点后第二位
D. 接近终点时,需用蒸馏水冲洗瓶壁和滴定管尖端悬挂的液滴
正确答案
(1)A
(2)防止Fe2+的水解;防止H2O2分解;三草酸合铁(Ⅲ)酸钾在乙醇中溶解度小
(3)BC
(4)防止吸水;检验晶体中的结晶水是否已全部失去
(5)生成的Mn2+起催化作用
(6)BC
解析
略。
知识点
中华人民共和国国家标准(GB2760-200-)规定葡萄酒中SO2最大使用量为0.25g·L-1.某兴趣小组用题9图I装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
(1)仪器A的名称是 ,水通入A的进口为 。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 。
(3)除去C中过量的H2O2,然后用0.0900mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择题9图2中的;若滴定终点时溶液的pH=8.8,则选择的指示剂为;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积 (填序号)(①=10mL,②=40mL,③<10mL,④>40mL)
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为 g·L-1
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:
正确答案
答案:(1)冷凝管或冷凝器,b (2)SO2+H2O2=H2SO4
(3)③;酚酞;④
(4)0.24
(5)原因:盐酸的挥发;改进措施:用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响。
解析
略
知识点
实验室制取少量溴乙烷的装置如右图所示。
根据题意完成下列填空:
(1)圆底烧瓶中加入的反应物是溴化钠、 和

A,天平
B,量筒
C,容量瓶
D,滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式。
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是 。
试管A中的物质分为三层(如图所示),产物在第 层。
(4)试管A中除了产物和水之外,还可能存在 、 (写出化学式)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法
是 (选填编号)。
A,蒸馏
B,用氢氧化钠溶液洗涤
C,用四氯化碳萃取
D,用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是 。
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是: 。
正确答案
(1)乙醇,B
(2)NaBr + (浓)H2SO4 → NaHSO4 +HBr ; CH3CH2OH +HBr 
(3)冷却,液封溴乙烷;3
(4)HBr、CH3CH2OH (合理给分)
(5)D,乙烯
(6)反应产生Br2,腐蚀橡胶
解析
略
知识点
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
正确答案
解析
略
知识点
Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
一,制备Na2S2O3•5H2O
反应原理:Na2SO3(aq)+S(s)
实验步骤:
① 称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml 乙醇润湿,加入上述溶液中。
② 安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。
③ 趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3•5H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是 。
(2)仪器a的名称是 ,其作用是 。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 ,检验是否存在该杂质的方法是 。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:
。
二, 测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L‾1碘的标准溶液滴定。
反应原理为:2S2O32‾+I2=S4O62-+2I‾
(5)滴定至终点时,溶液颜色的变化: 。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为 mL。产品的纯度为(设Na2S2O3•5H2O相对分子质量为M) 。
三, Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42‾,常用作脱氧剂,该反应的离子方程式为 。
正确答案
(1)使硫粉易于分散到溶液中
(2)冷凝管 冷凝回流
(3)
取少量产品溶于过量稀盐酸,过滤,向滤液中甲
(4)
(5)由无色变蓝色
(6)18.10
(7)
解析
略
知识点
某学习小组的三位同学为测定镀锌铁皮的镀层的厚度,提出了各自的设计方案。(忽略锌镀层的氧化)
甲同学的方案:先用盐酸将镀锌铁皮表面的锌反应掉,通过差量计算出锌的质量,然后再由锌的密度算出锌层的体积,最后由体积除以镀锌铁皮的面积计算得到锌层的厚度。
(1)甲同学的方案是否可行,说出理由: 。
乙同学的方案:通过查阅资料,知道Zn(OH)2既可以与酸也可与碱反应,于是设计了如下方案:
(2)配制5%的盐酸1 L (

(保留一位小数)。
(3)若使用的镀锌铁皮的质量为28.357g,最后称得灼烧后固体的质量为40.000g,镀锌铁皮的长5.00cm,宽5.00cm,锌的密度为7.14g/cm3,则锌层的厚度为 cm。
丙同学的方案:通过右图所示装置,测量镀锌铁皮与稀H2SO4反应产生气体的质量来计算锌层的厚度。己称得镀锌铁皮质量为18.200g。
(4)实验所用称量仪器为 。
(5)若改用浓盐酸,则测出锌的厚度会 (填“偏大”、“偏小”、或“无影响”)。
(6)实验后,将乙同学和丙同学的结果进行比较,发现他们对同种镀锌铁皮的测量结果差异很大,你认为谁的方案更加可靠呢?
理由是: 。
正确答案
(1)不可行 Fe也会和盐酸反应
(2) 118.9
(3) 0.001
(4) 电子天平
(5)偏小
(6) 乙 丙的方案中气体会带走水蒸气,易造成干扰。(1分)
解析
略
知识点
根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
(1)①废水I若采用CO2处理,离子方程式是_______。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO3-)越大,净水效果越好,这是因为_______。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++_______=CH3Hg++H+我国规定,Hg2+的排放标准不能超过0.05 mg/L。若某工厂排放的废水1 L中含Hg2+3×10-17mo1,是否达到了排放标准_______(填“是”或“否”)。
④废水Ⅳ常用C12氧化CN—成CO2和N2,若参加反应的C12与CN—的物质的量之比为5:2,则该反应的离子方程式为_______。
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化剂的量,换算成氧的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
I,取V1mL水样于锥形瓶,加入10.00 mL 0.2500 mol·L-1 K2Cr2O7溶液。
II,加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热。
III,反应完毕后,冷却,加指示剂,用c mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
①I中,量取K2Cr2O7,溶液的仪器是_______。
②III中,发生的反应为:Cr2O72-+6Fe2++14 H+=2Cr3++6Fe3++7H2O,由此可知,该水样的化学需氧量COD=_______(用含c、V1、V2的表达式表示)。
正确答案
(1)①OH-+CO2=HCO3-
②HCO3-会促进Al3+的水解,生成更多的Al(OH)3,净水效果增强
③CH4;是
④5 Cl2+2CN-+4H2O;10Cl-+2CO2+N2+8H+
(2)①酸式滴定管(或移液管);②
解析
(1)①据题意知废水I呈碱性,因此OH-+CO2=HCO3-,溶液的pH接近7。②HCO3-与铝离子发生相互促进的水解反应,使得产生更多的氢氧化铝沉淀。③利用元素守恒可知反应物为甲烷,
(2)①K2Cr2O7具有强氧化性应该用酸式滴定管或是移液管。②Cr2O72-+6Fe2++14 H+=2Cr3++6Fe3++7H2O,水样中的Cr2O72-为cV2×10-3×



知识点
8.下列有关实验的选项正确的是:( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.840g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的
请回答下列问题:
(1)称量样品所用的仪器为 (填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是 。
(2)装置a和c的作用分别是____和____(填标号,可以多选)。
a.除去SO2气体 b.除去空气中的水蒸气 c.有利于气体混合
d.有利于观察空气流速 e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是 。
(4)通过计算可知,该黄铜矿的纯度为 。
(5)若用下图装置替代上述实验装置d,同样可以达到实验目的的是 (填序号)。
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_______________________________________。
正确答案
(1)电子天平,使原料充分反应、加快反应速率
(2)b、d和e
(3)使反应生成的SO2全部进入d装置中,使结果精确
(4)50%
(5)②
(6) 空气中的CO2与Ba(OH)2反应生成BaCO3沉淀;BaSO3被氧化成BaSO4(合理答案均可)
解析
略
知识点
10.用下列装置进行相应实验,能达到实验目的的是( )
正确答案
解析
略
知识点
利用下列实验装置能完成相应实验的是
正确答案
解析
略
知识点
25.黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的
(1)称量样品所用的仪器为_____(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是_______ 。
(2)装置a和c的作用分别是____和____(填标号)。
a.除去SO2气体 b.除去空气中的水蒸气 c.有利于气体混合
d.有利于观察空气流速 e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____(填序号)。
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有________。
25.(15分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的
(1)称量样品所用的仪器为_____(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是_______ 。
(2)装置a和c的作用分别是____和____(填标号)。
a.除去SO2气体 b.除去空气中的水蒸气 c.有利于气体混合
d.有利于观察空气流速 e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____(填序号)。
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。
正确答案
10.下列定量仪器读数正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析