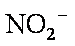- 化学实验
- 共767题
21.学校附近的湖水中浮萍疯长,助长水质恶化。湖水水样中可能含有Fe3+、Ba2+、K+、H+、NO3-、Cl-、CO32-、SO42-离子。为了进一步确认,取样进行实验检测:
①取水样仔细观察,呈透明、均一状态。
②用pH试纸测定污水的pH,试纸显红色。
③向水样中滴入KSCN溶液,呈红色。
④向水样中滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白色沉淀不消失。
(1)由此可知,该污水中肯定含有的离子是_______,肯定没有的离子是_______。
(2) 浮萍疯长的可能原因是水中含有较多的________离子。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验:

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
下列与实验相关的叙述正确的是
正确答案
解析
稀释浓硫酸是“酸入水”,故A错;若加水过量,溶液浓度已经变小,将水吸出,于事无补,唯一的办法就是重新配制溶液,故B错;若加入待测液前用待测液润洗锥形瓶,则必定会消耗更多的标准液,结果会偏高,C正确;D操作中,若溶液中含有Ag+,加入BaCl2后,也会有不溶于稀盐酸的白色沉淀生成,故D错。
知识点
某钠盐溶液中可能含有
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中公含
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
正确答案
解析
本题是离子组合推断、离子鉴别实验综合题。题型难点是:熟悉各种离子的标准检验方法,明确各种离子检验时的干扰因素。本题的难点还有:采用的出题方式和平时不同。
根据最终的离子分析:NO2-,存在时一定没有SO32-,I-。因NO2-,的氧化性可以使他们氧化。Cl-存在下的NO2-的检验:加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体。即证明了NO2-的存在又检验出Cl-的存在。但,仅加入盐酸产生刺激性气体也可能有SO32-的存在。故须先确认SO32-不存在。SO32-,CO32-,SO42-的组合检验可以用:加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。来确认SO32-, SO42-不存在,CO32-一定存在。故选择③④就可以,顺序是先④后③。
知识点
某未知溶液可能含Cl-、CO32-、Na+、SO42-、Al3+。将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是
正确答案
解析
略
知识点
27.某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4(+)、Cl-、CO3(2-)、SO4(2-),现分别取100 mL的三等份溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生。
②第二份加过量NaOH溶液加热后,只收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。
③在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。
④第三份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65 g。
根据上述实验回答:
(1)一定不存在的离子是,不能确定是否存在的离子是( )。
(2)试确定溶液中肯定存在的离子及其浓度(可不填满):离子符号,浓度( ) ; 离子符号,浓度 ; 离子符号,浓度( )。
(3)试确定K+是否存在,( )(填“是”或“否”),判断的理由是( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.某溶液可能含有下列离子中的几种:K+、NH+4、NO-3、SO2-4,SO2-3,CO2-3,进行如下实验:
①取10mL溶液与足量烧碱共热,产生标准状况下气体22.4mL
②另取10mL原溶液加入足量盐酸无明显现象,再加足量BaCl2溶液得0.233g白色固体,则该溶液中:()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:
①pH试纸检验,溶液的pH=13。
②取少量原溶液,向溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。
③另取少量原溶液,向溶液中滴加足量氯水,无气体产生,再加入CCl4振荡,静置后CCl4层呈橙色,用分液漏斗分液。
④向分液后的水溶液中加入Ba(NO3)2溶液和HNO3溶液,有白色沉淀产生,过滤。
⑤在滤液中加入AgNO3和HNO3的混合溶液有白色沉淀产生。
则关于原溶液的判断中不正确的是:()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.某无色溶液中只可能含有①Na+ ②Ba2+ ③NO-3 ④Cl- ⑤Br- ⑥SO2-3 ⑦SO2-4离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。
下列结论正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3—、Cl—、MnO4—、SO42—等离子中的几种离子。
①经实验可知溶液明显呈酸性。
②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀甲,向滤液中加入AgNO3溶液未见沉淀产生。
③另取少量该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当沉淀增加到一定量后开始产生气体丙,最后沉淀完全溶解。
(1)写出气体丙的电子式___________________。
(2)该溶液中一定不含有:___________________(填离子的化学式)离子,一定含有的离子有___________(填离子的化学式)。
(3)在这些不存在的离子中,有一种离子在酸性环境中与SO2反应,试写出该反应的离子方程式:________________________。
(4)请设计实验方案,检验该试液中是否存在可能含有的离子____________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
强电解质甲、乙、丙、丁分别溶于水,电离出NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-(每种溶液中溶质电离出的离子各不相同)。已知:① 甲溶液分别与其它三种溶液混合,均产生白色沉淀;② 0.1 mol·L-1乙溶液中c(H+)>0.1 mol·L-1;③ 向丙溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀。下列结论不正确的是
正确答案
解析
略
知识点
学习小组设计了如下图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
(1)通入氯气后,a中的现象是 。
c装置中发生反应的离子方程式为: 。
(2)d装置的所发生反应的离子方程式
(3)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-。设计试验方案,
检验洗气瓶B溶液中Cl-和SO42-的存在。在答题卡上补充填写出实验步骤、预期现象
和结论。(可填满也可不填满)限选试剂及仪器:2 mol/LHCl、2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(NO3)2溶液、0.1 mol/LAgNO3溶液、澄清石灰水、试管、胶头滴管。
(4)上述实验需要100mL,2mol/L的HCl,配制时量筒量取36.5%,密度1.19g/mL的浓盐酸的体积为 mL
正确答案
(1)溶液变蓝色,(2分)2Fe2++Cl2== 2Fe3++2Cl-(2分)
(2)Cl2 + 2OH- = Cl- + ClO- + H2O(2分)
(3)(8分)(合理即给分)
(若在步骤2中:先加足量2 mol/L HNO3,再滴加入过量l mol/LBa(NO3)2溶液,(1分)振荡,静置。
则在步骤3中就不需要再加入过量的2 mol/L HNO3。)
(4)16.8mL(2分)
解析
略
知识点
某无色溶液可能含有①Na+ ②Ba2 + ③Cl一 ④Br一 ⑤SO32一 ⑥SO42一中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
下列结论正确的是
正确答案
解析
略
知识点
有一固体混合物,可能含有FeCl2、NaNO2、Ba(OH)2、A1C13、Na2SO3中的若干种。取适量该混合物加适量水充分搅拌,得到白色沉淀A与无色溶液B。
①取少量A加入稀硝酸至过量,白色沉淀部分溶解
②取少量B逐滴加入稀硫酸至过量,不断生成白色沉淀后沉淀部分溶解
③取少量B滴加少量酸性高锰酸钾,振荡,最终得无色溶液
根据上述实验现象,以下推测正确的是 ( )
正确答案
解析
略
知识点
9.(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料] (NH4)2SO4在2600C和4000C时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于2600C加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,去下装置B,加入指示剂,用0.2000mol/LNaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00Ml。经检验滴定后的溶液中无SO42-.
(1)仪器X的名称是________________.
(2)滴定前,下列操作的正确顺序是_________(填字母编号)。
a. 盛装0.2000mol/LNaOH溶液
b. 用0.2000mol/LNaOH溶液润洗
c. 读数、记录
d. 查漏、清洗
e. 排尽滴定管尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是__________mol
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,与4000C加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2.观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是__________.
(5)装置B内溶液吸收的气体是____________.
(6)(NH4)2SO4在4000C分解的化学方程式是______________________.
正确答案
(1)圆底烧瓶
(2)dbaec
(3)0.03
(4)取少量装置D内溶液于试管中,滴加BaCl2溶液,生成白色沉淀;加入足量稀盐酸后沉淀完全溶解,放出无色刺激性气体
(5)NH3或氨气
(6)3(NH4)2SO4
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析