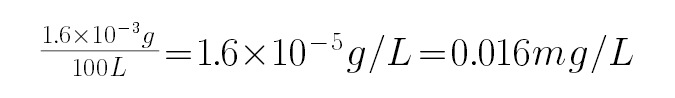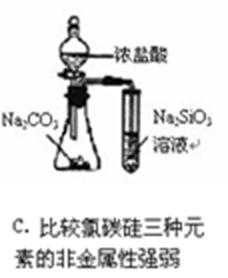- 化学实验
- 共767题
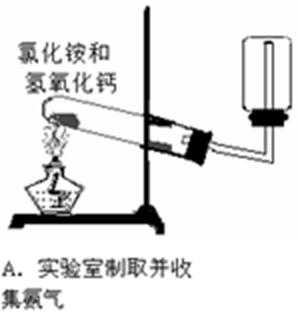
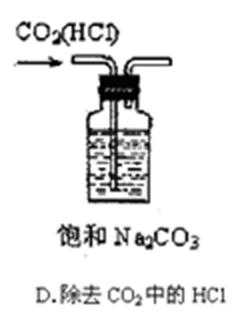
11.下列实验操作、现象和结论均正确的是
正确答案
解析
A,蔗糖脱水,表现出浓硫酸的脱水性,而不是吸水性;
B,K+通过焰色反应检验,必须透过蓝色钴玻璃观察是否有紫色;
C,实验现象只能证明酸性:盐酸大于硅酸,但其中的氯元素并不是最高价,所以不能得出,氯的非金属性大于硅;
D,组成形式的沉淀物转化证明变成了更难溶的,能说明它的溶度积常数更小。
考查方向
浓硫酸的性质;焰色反应的具体操作;非金属性的比较;溶度积常数的理解。
解题思路
浓硫酸的吸水性表现为物理变化,而农硫酸的脱水性表现为化学变化。
Na+可以直接肉眼观察焰色现象,但是钾离子,必须透过蓝色钴玻璃。
非金属性,如果通过酸性来比较的话,必须是各元素的最高价氧化物,对应水化物,
易错点
浓硫酸的吸水性与脱水性;最高价氧化物对应水化物的酸性或碱性比较,往往会忽略掉最高价。
教师点评
本题整体难度不大,注意双基的练习。
知识点
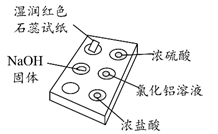
8.右图是用点滴板探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板。
正确答案
D
解析
A. NH3极易溶于水且与水反应显碱性才使红色石蕊试纸变蓝,故A错误;
B. 浓硫酸附近无白烟是因为浓硫酸的难挥发性,浓硫酸能与氨气反应生成铵盐,故B错误;
C.离子方程式中NH3·H2O 是弱电解质,不能拆,故C错误;.正确。
考查方向
解题思路
氨气的物理性质与化学性质。
易错点
忽视浓硫酸的酸性而错选B。
知识点
目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:
34.操作X所需要的主要玻璃仪器为 ,该仪器使用前须检漏,检漏方法
为 。
35.反萃取时加入20%的NaOH溶液,其离子方程式为 。
36.溴的传统生产流程为先采用氯气氧化,再用热空气将Br2吹出。与传统工艺相比,萃取法的优点是 。
37.设计右图装置的实验目的是_____________,实验操作步骤如下:①打开弹簧夹,缓缓通入氯气②当a和b中的溶液都变为黄色时,夹紧弹簧夹。③当a中溶液由黄色变为棕色时,停止通氯气。④ 。
请回答:
设计步骤③的实验目的是 _________________________ 。
步骤④的操作是 __________________
正确答案
分液漏斗(只答烧杯不给分) 向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水
解析
富马酸废液中含有Br-,电解生成溴单质,加入四氯化碳萃取后分液,再加入氢氧化钠反萃取得到含溴离子和次溴酸根离子的溶液,加入硫酸酸化发生氧化还原反应生成溴单质;操作X为萃取分液,需主要的玻璃仪器为液漏斗;检分液漏斗查漏的方法为:向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水
考查方向
基本操作、基本仪器的使用
解题思路
富马酸废液中含有Br-,电解生成溴单质,加入四氯化碳萃取后分液,再加入氢氧化钠反萃取得到含溴离子和次溴酸根离子的溶液,加入硫酸酸化发生氧化还原反应生成溴单质.操作X为萃取分液;向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水
易错点
分液漏斗的检漏方法叙述
教师点评
本题考查基本操作、基本仪器的使用,题目难度不大
正确答案
Br2 +2OH- Br- + BrO- +H2O(写Br2+6OH- 5Br- + BrO3- +3H2O亦给分)
解析
萃取时加入20%的NaOH溶液与溴反应生成溴化钠、次溴酸钠和水,反应的离子方程式为:Br2+2OH-=Br-+BrO-+H2O
考查方向
物质的性质、离子反应
解题思路
反萃取时加入20%的NaOH溶液与溴反应生成溴化钠、次溴酸钠和水
易错点
离子方程式书写
教师点评
本题考查物质的性质、离子反应,题目难度不大
正确答案
没有采用有毒气体Cl2,更环保;溴中不含氯气,所得溴更纯净
解析
传统工艺相比,萃取法的优点是:没有采用有毒气体Cl2,更环保;溴中不含氯气,所得溴更纯净,
故答案为:没有采用有毒气体Cl2,更环保;溴中不含氯气,所得溴更纯净
考查方向
化学实验方案的优选
解题思路
无有毒气体氯气参加反应,生产过程环保,所得溴更纯净
易错点
所得的溴更纯净
教师点评
本题考查化学实验方案的优选,题目难度中等,需要学生具备扎实的基础
正确答案
比较氯.溴.碘的非金属性
排除Cl2对溴.碘的非金属性的强弱实验的干扰(证明b中Cl2已充分反应)
打开活塞d,将少量b中溶液滴入c中,关闭活塞d,取下试管c震荡(漏写一个得1分)
解析
根据具体的操作与装置图,可知该实验的目的是:比较氯、溴、碘的非金属性,
步骤③的目的:排除Cl2对溴、碘的非金属性的强弱实验的干扰,证明b中Cl2已充分反应,
步骤④是将b中溴与c中溶液混合,验证溴的非金属性比碘的强,具体操作为:打开活塞d,将少量b中溶液滴入c中,关闭活塞d,取下试管c震荡
考查方向
非金属性强弱比较、实验方案设计
解题思路
根据具体的操作与装置图,可知该实验的目的是:比较氯、溴、碘的非金属性;
步骤③证明b中Cl2已充分反应,排除氯气的干扰;
步骤④是将b中溴与c中溶液混合,验证溴的非金属性比碘的强
易错点
步骤③的实验目的
教师点评
本题考查非金属性强弱比较、实验方案设计,题目难度较大
24.铁及其化合物有重要用途,如聚合硫酸铁[Fe2(0H)n(S04)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某化学探究小组设计如下方案制备上述两种产品:
请回答下列问题:
(1)检验固体铁的氧化物中铁的化合价,应使用的试剂是( )(填标号)
A.稀硫酸 B.稀硝酸
C.KSCN溶液 D.酸性高锰酸钾溶液
(2)在溶液Ⅰ中加入NaClO3,写出其氧化Fe2+的离子方程式:( ) 。
(3) Fe2O3与KNO3和KOH的混合物加热共融可制得高铁酸鉀。完成并配平下列化学方程式:
(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 O.1OOOmol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:
①写出滴定选用的指示剂( ) ,滴定终点观察到的现象 ( )。
②溶液Ⅰ中铁元素的总含量为( )g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会( ) (填“偏高” “偏低” “不变”)。
24.铁及其化合物有重要用途,如聚合硫酸铁[Fe2(0H)n(S04)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某化学探究小组设计如下方案制备上述两种产品:
请回答下列问题:
(1)检验固体铁的氧化物中铁的化合价,应使用的试剂是 (填标号)
正确答案
空气是人类赖以生存的自然资源。在工业生产上规定,空气中二氧化硫的最大允许排放浓度不得超过0.02mg·L-1。
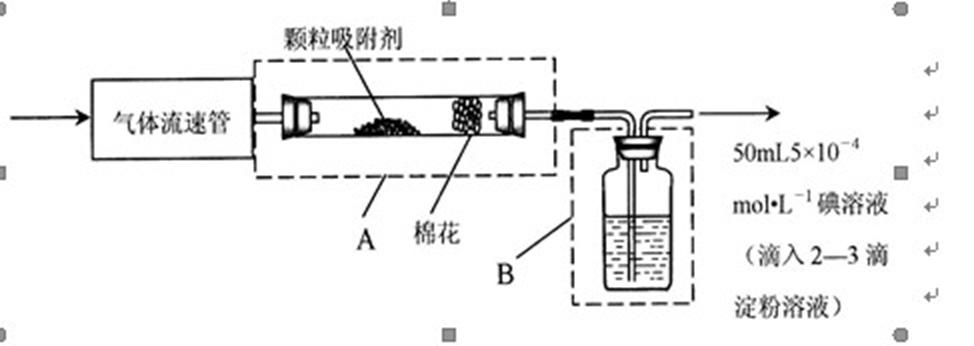
8.为测定某地方空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
注:气体流速管是用来测量单位时间内通过气体体积的装置①上述实验过程中化学反应的原理是_________(用化学方程式表示)。②应用上述装置测定空气中SO2含量和可吸入颗粒的含量,除测定气体流速(单位:mL· s-1)外,还需要测定碘溶液蓝色褪去所需的时间和_________。③己知:碘单质微溶于水,KI可以增大碘在水中的溶解度。请你协助甲同学完成l00mL5×10-4mo1·L-1碘溶液的配制。为配制精确浓度的溶液,先
要配制1000mLl×10-2 mol·L-1碘溶液,再取5.00mL溶液稀释成为5×10-4mol·L-1碘溶液。
第一步:准确称取_____g碘单质加入烧杯中,同时加入少量碘化钾固体,加适量水搅拌使之完全溶解。
第二步:______,洗涤、定容、摇匀。
第三步:用第二步所得溶液配制5×10-4mo1·L-1碘溶液,此步操作中,除烧杯、玻璃棒、胶头滴管外还需要的玻璃仪器有________(填仪器名称)。
9.空气中SO2含量的测定:①在指定的地点取样,以200mL·s-1气体流速通过气体流速管通入到上图实验装置中,观察记录碘溶液褪色所需时间为500 s,则该地空气中的SO2含量是____mg·L-1,________(填“符合”、“不符合”)排放标准。②如果甲同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,其原因可能是___________;___________(假设溶液配制、称量或量取及各种读数均无错误)”。
正确答案
①SO2+I2+2H2O = H2SO4+2HI (2分)②装置A在反应前后的质量。[或吸收前后颗粒吸附剂、棉花、玻璃管(盛放容器)的总质量(2分)] ③2.54(2分);将第一步所得溶液全部转入1000 mL的容量瓶中(1分);移液管(或酸式滴定管) 100mL容量瓶(2分,各1分)
解析
①二氧化硫用碘溶液来吸收,反应的化学方程式为:SO2+I2+2H2O═2HI+H2SO4,
②要测可吸入颗粒的含量,可用颗粒吸附剂来吸收,颗粒吸附剂前后质量之差即为可吸入颗粒的质量,则应测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量,测定SO2含量,除测定气体流速(单位:cm3•min-1)外,还需要测定溶液蓝色恰好褪去所需的时间;
③第一步:为配制精确浓度的溶液,先要配制1000mL l×10-2 mol•L-1碘溶液,再取5.00mL溶液稀释成为5×10-4mol•L-1碘溶液.计算需要称量碘单质的质量=1L×l×10-2 mol•L-1 ×254g/mol=2.54g;
第二步:由题意可知碘单质微溶于水,KI可以增大碘在水中的溶解度,则准确称取2.54g碘单质加入烧杯中,同时还应加入少量碘化钾固体,加适量水搅拌使之完全溶解,则第二步操作应将第一步所得溶液全部转入1000 mL的容量瓶中,定容,摇匀,
则从第二步所得溶液中,取出10.00mL溶液于100mL容量瓶中,加水稀释至刻度线,可得碘溶液;
第三步:用第二步所得溶液配制5×10-4mo1•L-1碘溶液100ml,此步操作中,除烧杯、玻璃棒、胶头滴管外还需要的玻璃仪器有移液管(或酸式滴定管) 100mL容量瓶
考查方向
物质组成的实验探究分析、溶液配制
解题思路
二氧化硫用碘溶液来吸收生产历史和碘化氢,测定SO2含量,除测定气体流速(单位:cm3•min-1)外,还需要测定溶液蓝色恰好褪去所需的时间,要测可吸入颗粒的含量,可用颗粒吸附剂来吸收,颗粒吸附剂前后质量之差即为可吸入颗粒的质量,则应测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量;准确称取碘单质的质量=1L×l×10-2 mol•L-1 ×254g/mol=2.54g,碘单质加入烧杯中,同时还应加入少量碘化钾固体,依据配制100ml溶液的步骤选择需要的玻璃仪器
易错点
溶液的配制步骤完善
教师点评
本题考查了物质组成的实验探究分析、溶液配制过程等知识,掌握基础是解题关键,题目难度中等
正确答案
①0.016(2分);符合(1分) ②气体流速过快,吸收不完全(或未充分反应);(1分)装置气密性较差(1分)
解析
①碘单质物质的量=0.050L×5×10-4mol/L=2.5×10-5mol,
SO2+I2+2H2O=H2SO4+2HI
二氧化硫物质的量为2.5×10-5mol,
质量为2.5×10-5mol×64g/moL=1.6×10-3g,
以200mL•s-1气体流速通过气体流速管通入到上图实验装置中,观察记录碘溶液褪色所需时间为500s,体积=200mL•s-1×500s=100000ml,所以空气中SO2的含量为
,空气中二氧化硫的最大允许排放浓度不得超过0.02mg•L-1,则此气体符合排放标准,
②如果抽气速度过快,部分二氧化硫可能来不及和碘水反应,从而导致测得的数值比实际含量低;吸收不完全测定结果会偏低;如果装置漏气时,部分二氧化硫会逸散出广口瓶,从而导致测得的数值比实际含量低
考查方向
气体含量计算、误差分析
解题思路
①依据化学方程式定量关系计算,SO2+I2+2H2O=H2SO4+2HI;
②如果抽气速度过快,部分二氧化硫可能来不及和碘水反应;如果装置漏气时,部分二氧化硫会逸散出广口瓶
易错点
误差分析
教师点评
本题考查了气体含量计算、误差分析应用等知识,掌握基础是解题关键,题目难度中等
下列检验气体是否收集满所用试纸不恰当的是
正确答案
解析
略
知识点
下列有关实验原理或操作正确的是
正确答案
解析
略
知识点
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如下:
(1)①铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。
②铜帽溶解后需将溶液中过量H2O2除去。除去H2O2的简便方法是 。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点。上述过程中的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为 ,滴定终点观察到的现象为 。
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会 (填“偏高”“偏低”“不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了
几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)
实验中可选用的试剂:30% H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1 NaOH。
由除去铜的滤液制备ZnO的实验步骤依次为:① ;
② ;
③过滤;
④ ;
⑤过滤、洗涤、干燥
⑥900℃煅烧。
正确答案
见解析。
解析
(1)①Cu+H2O2+H2SO4=CuSO4+2H2O ②加热(至沸)
(2)①淀粉溶液 蓝色褪去 ②偏高
(3)①向滤液中加入30%的H2O2使其充分反应
②滴加1.0 moL· L-1的氢氧化钠,调节pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全
④向滤液中滴加1.0 moL· L-1的氢氧化钠,调节pH约为10(或8.9≤pH≤11),使
Zn2+沉淀完全
本题以实验室利用废弃旧电池的铜帽回收铜并制备ZnO制取和分析为背景的综合实验题,涉及元素化合物知识、氧化还原滴定、指示剂选择、误差分析、实验步骤、pH调节等多方面内容,考查学生对综合实验处理能力。
知识点
下列有关仪器使用方法或实验探作正确的是
正确答案
解析
略
知识点
Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3 溶液,生成Ag2O沉淀,保持反应温度为80,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。反应方程式为2AgNO3+4KOH+K2S2O8
回答下列问题:
(1)上述制备过程中,检验洗涤是否完全的方法是_________。
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2 转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:_________。
(3)准确称取上述制备的样品(设Ag2O2仅含和Ag2O)2.558g,在一定的条件下完全分解为Ag 和O2 ,得到224.0mLO2(标准状况下)。计算样品中Ag2O2的质量分数(计算结果精确到小数点后两位)。
正确答案
(1)取少许最后一次洗涤滤液,滴入1~2滴Ba(NO3)2溶液,若不出现白色浑浊,表示已洗涤完全(取少许最后一次洗涤滤液,滴入1~2滴酚酞溶液,若溶液不显红色,表示已洗涤完全)
(2)Ag2O2+2Zn+4KOH+2H2O=2K2Zn(OH)4+2Ag
(3)n(O2)=224mL/22.4L·mL-1·1000mL· L-1=1.000×10-2 mol
设样品中Ag2O2的物质的量为x, Ag2O的物质的量量为y
248g·mol-1 × x + 232 g·mol-1 × y =2.588 g
x+1/2 y =1.000×10-2 mol
x=9.500×10-3 mol
y=1.000×10-3 mol

解析
略。
知识点
27.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
回答下列问题:
(1) SnCl2用盐酸而不用水直接溶解的原因是:( )
加入锡粉的作用是:( )
(2) 反应I生成的沉淀为SnO,写出该反应的化学方程式:
(3) 检验沉淀已经“洗涤”干净的操作是:( )(3分)
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0mol·L—1,则室温下应控制溶液pH( )。(已知:Ksp[Sn
(5)酸性条件下,SnSO4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:( )。
(6)潮湿环境中,镀锡铜即使锡层破损也能防止形成铜绿,请结合有关的原理解释其原因:
( )。
正确答案
(1)抑制Sn2+水解, 防止Sn2+被氧化
(2)SnCl2 + Na2CO3 = SnO + CO2↑+2NaCl
(3)取少量最后
(4)小于1 (若写成≤1给1分)
(5)Sn2+ + H2O2 + 2H+ = Sn4+ + 2H2O
(6)潮湿环境中,Sn与Cu构成原电池,Sn作为负极,保护正极Cu不被氧化
解析
解析已在路上飞奔,马上就到!
知识点
4.下列关于甲、乙、丙、丁四组仪器装置的有关用法正确且能达到目的的是( )
正确答案
解析
解:A.二氧化硫和水反应生成亚硫酸,亚硫酸酸性大于硅酸,所以二氧化硫能和硅酸钠反应生成硅酸,但亚硫酸不是S元素最高价氧化物的水化物,所以不能据此判断S、Si的非金属性强弱,故A错误;
B.酸应该加在酸式滴定管中。
C. 固体溶质不能在容量瓶中溶解,C项不正确.
D.NO不溶于水,可以采用排水法收集,如果该集气瓶中装满水,导气管遵循“短进长出”原则,故D正确;
考查方向
解题思路
该题的易错选项是A
关于广口瓶在实验中的多功能应用总结如下:
A装置可作集气瓶和洗气瓶,例如,利用A装置收集或干燥以下三种气体。①Cl2 ②NH3 ③NO(答案均填序号)
Ⅰ.若集气瓶是干燥的,则由b口进气可收集气体②。
Ⅱ.若集气瓶是干燥的,则由a口进气可收集气体①。
Ⅲ.若集气
Ⅳ.若集气瓶内装入浓硫酸进行气体干燥,气体由a口进入,可用此装置干燥的气体是①③。
易错点
1、非金属性强弱判断、气体收集等知识点。
2、明确实验原理是解本题关键,会从装置的评价性、操作的规范性判断,题目难度中等。
知识点
化工厂铬渣中含有Na2SO4及少量Cr2O72-、Fe3+,下面是从铬渣提取Na2SO4和利用副产品制取FeCl3的工艺流程。已知:Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol•L-1)时pH分别为3.6和5。
(1)①操作C加硫酸酸化而不选用盐酸的原因是________。
②酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为________。
③根据溶解度(S)∽温度(T)曲线,操作B的最佳方法为________(填字母序号)。
A. 蒸发浓缩,冷却结晶,过滤
B. 蒸发浓缩,趁热过滤
④温度相同时Ksp[Cr(OH)3]________Ksp[Fe(OH)3](填“>”或“<”)
(2)已知FeCl3从溶液中析出的是FeCl3•6H2O,在空气中直接加热FeCl3•6H2O晶体得不到纯的无水FeCl3,原因是________(用化学方程式表示)。由FeCl3•6H2O晶体得到纯的无水FeCl3的合理方法是________。
(3)下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是________。
A. a—b—c—d—e—e—f—g—h
B. a—c—b—d—e—h—i—f
C. a—d—e—c—b—h—i—g
D. a—e—d—c—b—h—i—g
若以KMnO4和浓盐酸为原料来制取Cl2,并希望能控制反应速率,下列最适合的装置是________(已知:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2
正确答案
(1)①酸性环境Cl-被Cr2O72-氧化生成Cl2污染环境,引入NaCl杂质导致产品不纯;②3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;③B;④>
(2)FeCl3•6H2O
(3) D;④
解析
略。
知识点
亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:① NO+NO2+2OH-=2NO2-+H2O
② 气体液化的温度:NO2 21℃ 、 NO –152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):
A 、 C 、 、 、
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是 。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是 。
②装置E的作用是 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。
如果没有装置C,对实验结论造成的影响是 。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是 。
正确答案
见解析。
解析
(1) E 、 D 、 B
(2) 防止可能生成的NO被完全氧化成NO2 ,造成对A中反应气体产物检验不完全
(3)① D中出现红棕色气体 ② 冷凝使NO2完全液化
(4) 4NO2 + O2 + 4NaOH = 4NaNO3 +2 H2O
水蒸气存在,会与NO2反应产生NO,造成对NO来源于哪里的认识不清
(5) 2NaNO2 + H2SO4 = Na2SO4 + NO2↑ + NO↑+ H2O
知识点
9.下列实验中,能够达到实验目的的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析