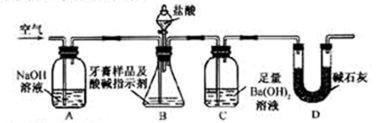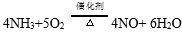- 实验综合
- 共44题
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
(1)摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水成分搅拌、过滤。
1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是_______。
2)往1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是_______。
(2)牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:________。
4)C中反应生成BaCO3的化学方程式是___________。
5)下列各项措施中,不能提高测定准确度的是_____________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A—B之间增添盛有浓硫酸的洗气装置
d. 在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g 。则样品中碳酸钙的质量分数为_________。
7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是__________。
正确答案
见解析。
解析
1)氢氧化铝与NaOH溶液反应的离子方程式书写,要求基础。
Al(OH)3+OH-=[Al(OH)4]-或Al(OH)3+OH-=AlO2-+2H2O
2)生成的是NaAlO2溶液,通入CO2气体有Al(OH)3白色沉淀生成,并且生成NaHCO3,加入盐酸有CO2气体产生、Al(OH)3沉淀溶解。学生完整描述实验现象要比较扎实的基本功。
3)实验过程中需持续缓缓通入空气,把生成的CO2全部排入C中,使之完全被Ba(OH)2溶液吸收。这样设问学生经常接触。
4)CO2+Ba(OH)2=BaCO3↓+H2O,基础简单的方程式书写。
5)在加入盐酸之前,应排净装置内的CO2气体,会影响测量,滴加盐酸不宜过快,保证生成的CO2完全被吸收。在A—B之间增添盛有浓硫酸的洗气装置,因为整个装置中不需要干燥,有水份不会影响CO2吸收。在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置,C瓶中是足量Ba(OH)2,可以吸收CO2中的HCl,而不影响CO2吸收,所以不需要除去CO2中的HCl,选cd。
6)BaCO3质量为3.94g ,n(BaCO3)=0.0200mol, 则n(CaCO3)=0.0200mol,质量为2.00g,则样品中碳酸钙的质量分数为25%。此问计算比较简单。
7)Ba(OH)2溶液还吸收了水蒸气、氯化氢气体等,造成质量偏大,所以可以回答B中的水蒸气、氯化氢气体等进入装置C中。
知识点
按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物:
下列说法错误的是
正确答案
解析
步骤(1)是分离固液混合物,其操作为过滤,A项正确;步骤(2)分离互不相溶的液体混合物,需进行分液,要用到分液漏斗,B项正确;步骤(3)是从溶液中得到固体,操作为蒸发,需要蒸发皿,C项错误;步骤(4)是从有机化合物中,利用沸点不同采取蒸馏得到甲苯,D项正确。
知识点
下列实验可实现鉴别目的是( )
正确答案
解析
略
知识点
CaCO3广泛存在于自然界,是一种重要的化工原料。
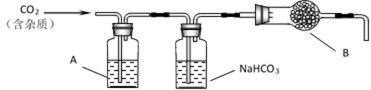
大理石主要成分为CaCO3,另外有少量的含硫化合物。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
完成下列填空:
(1)用浓盐酸配制l∶l(体积比)的稀盐酸(约6mo1/L),应选用的仪器是_________________。
a,烧杯 b,玻璃棒 c,量筒 d,容量瓶
(2)上述装置中,A是_______________溶液,NaHCO3溶液可以吸收__________________。
(3)上述装置中,B物质是_______________。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果__________________(填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重 → 浸泡溶解 → 过滤 → 残渣烘干 → 冷却、称重 → 恒重
为了将石蜡和碳酸钙溶出,应选用的试剂是___________________________。
a,氯化钠溶液 b,稀醋酸 c,稀硫酸 d,正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出_______________,后溶出________________________。
(6)上述测定实验中,连续_____________________________________,说明样品已经恒重。
正确答案
(1)abc
(2)CuSO4溶液或酸性KMnO4溶液;吸收HCl气体或吸收酸性气体
(3)无水CaCl2 偏低
(4)b d
(5)石蜡 CaCO3
(6)两称量的结果相差不超过(或小于)0.001
解析
略
知识点
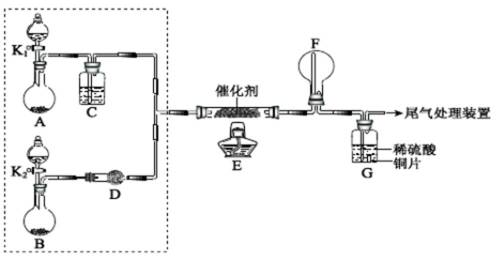
某小组同学欲探究NH3催化氧化反应,按下图装置进行实验。
A、B装置可选药品:浓氨水、H2O2、蒸馏水、NaOH固体、MnO2
(1)NH3催化氧化的化学方程式是 。
(2)装置B中产生气体的原因有(结合化学用语解释) 。
(3)甲乙两同学分别按上述装置进行实验。一段时间后,装置G中溶液都变成蓝色。
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是 。
②乙观察到装置F中只有白烟生成,白烟的成分是(写化学式) 。
③用离子方程式解释装置G中溶液变成蓝色的原因: 。
(4)为帮助乙实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进。
①甲认为可调节K1和K2控制A、B装置中的产气量,应(填“增加”或“减少”)
装置A中的产气量,或(填“增加”或“减少”) 装置B中的产气量。
②乙认为可在装置E、F间增加一个装置,该装置可以是(填序号) 。
(5)为实现该反应,也可用下图所示的装置替换上述
装置中虚线框部分,化合物X为 。
NH4HCO3的作用是 。
正确答案
见解析。
解析
(1)
(2)在氨水中存在平衡:NH3 + H2O 

(3)①2NO+O2==2NO2
②NH4NO3
③3Cu+ 8H++2NO3—=3Cu2+ +2NO↑+4H2O
(4)①增加 减少
②abc
(5)Na2O2
NH4HCO3分解放出NH3;同时放出的CO2和H2O与Na2O2反应生成O2
知识点
扫码查看完整答案与解析