- 元素质量分数的计算
- 共33题
19.氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:
已知:几种化合物的溶解度(S)随温度(T)变化曲线如图所示。
(1)过滤时主要玻璃仪器有 。
(2)检验反应I是否进行完全的方法是: 。
(3)反应II为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl,由Mg(ClO3)2溶液制取Mg(ClO3)2·6H2O的实验步骤依次为:
① ;
②趁热过滤;
③ ;
④过滤、洗涤、干燥。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量m g产品配成100 mL溶液。
步骤2:取10 mL溶液于锥形瓶中,加入10 mL稀硫酸和24mL1.0000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.1000mol·L-1 K2Cr2O7标准溶液滴定未被氧化的Fe2+,发生的反应为:6Fe2+ + Cr2O72- +14H+ =6Fe2+ +2Cr3+ +7H2O
达滴定终点时,记录消耗K2Cr2O7的体积。再重复三次相同实验,得到数据分别为20.04mL、20.00mL、16.92mL、19.96mL。
①步骤2中发生反应的离子方程式为: 。
②若标定过程中没有误差,实际测定Mg(ClO3)2·6H2O的含量偏高,原因可能是________________。
(5)计算Mg(ClO3)2·6H2O的质量分数。
正确答案
(1)漏斗、玻璃棒、烧杯
(2)取少量溶液于小试管中,向其中滴加几滴酸性KMnO4溶液,若紫色褪去,则Fe2+未反应完全,反之则反应完全。
(3)蒸发浓缩 冷却结晶
(4)
①ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O
②Mg(ClO3)2·6H2O 可能失去了结晶水
(5) ClO3- ~ 6Fe2+ ~ Cr2O72-
n(ClO3-) 0.02*0.1=0.002 mol
n(ClO3-) =0.002mol
n[ Mg(ClO3)2·6H2O]=0.001mol
w[ Mg(ClO3)2·6H2O]=
解析
解析已在路上飞奔,马上就到!
知识点
18.钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ;
步骤③中反应的离子方程式为: 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将 (填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
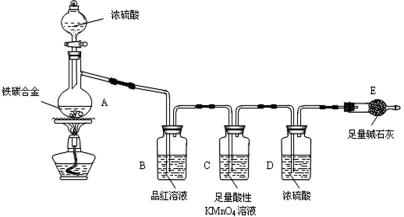
28.现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
I 测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后__________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为__________________________(写表达式)。
(3)装置C的作用______________________________________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是___________________________________________________________。
(5)乙同学按照甲同学认为改进实验,改进方法是______________但测得合金中铁的质量分数却偏高。你认为其中可能的原因是_________________。
Ⅱ 探究浓硫酸的某些性质:
(6)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:________________________________________________。
(7)A中铁与浓硫酸发生反应的化学方程式是_______________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析