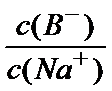- 化学反应速率的概念
- 共9题
15.常温下,将一定浓度的HA和HB分别与0.10 mol·L-1的NaOH溶液等体积混合,实验记录如下表:
正确答案
解析
分析表格数据①HA与等物质的量NaOH溶液反应为恰好反应生成正盐,溶液呈碱性可知盐为强碱弱酸盐②HB与NaOH溶液反应,且酸过量,经过假定强酸验证到PH=2可知该酸为强酸,由此可知A错误,由于HB为强酸,不存在电离平衡和水解平衡,因此温度变化不能改变浓度,故错误。C.根据盐类水解,酸根离子浓度小于钠离子浓度。故选择D正确。
考查方向
解题思路
分析表格数据,根据强弱电解质的特点及结论加以验证
易错点
强弱电解质的判断,PH计算,离子浓度大小比较的规律
知识点
用0.1 mol•L-1 NaOH溶液分别滴定体积均为20 mL、浓度均为0.1 mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图:
21.HX为( )酸(填“强”或“弱”)。
22.N点pH>7的原因是(用化学用语表示)________。
23.下列说法正确的是________(填字母)。a. M点c(HX)<c(X-) b. M点c(Na+)>c(OH-) c. P点c(Cl-)=0.05 mol•L-1
正确答案
(1)弱
解析
(1)读图可知两条曲线上面是HX,下面是盐酸,当HX中加入等体积氢氧化钠时Ph>7,可知HX是弱酸
考查方向
解题思路
本题的解题重点在于读图,能够从图中读出两条曲线上面是HX,下面是盐酸,可知HX是弱酸,当横坐标为10、20ml时两酸的pH变化是不同的,因为生成的NaX是强碱弱酸盐,会发生水解。
易错点
无法从二维图中读出所需数据进行分析
正确答案
(2)X-+H2O
解析
(2)其盐NaX会发生水解,X-+H2O
考查方向
解题思路
本题的解题重点在于读图,能够从图中读出两条曲线上面是HX,下面是盐酸,可知HX是弱酸,当横坐标为10、20ml时两酸的pH变化是不同的,因为生成的NaX是强碱弱酸盐,会发生水解。
易错点
无法从二维图中读出所需数据进行分析
正确答案
(3)b
解析
(3)M点是半体积点,此时溶液中NaX与HX物质的量之比为1:1,pH>7,说明水解程度大于电离程度,因此a错,b 正确,c应该是P点c(Cl-)=(0.1*0.02/0.03) mol·L-1.
考查方向
解题思路
本题的解题重点在于读图,能够从图中读出两条曲线上面是HX,下面是盐酸,可知HX是弱酸,当横坐标为10、20ml时两酸的pH变化是不同的,因为生成的NaX是强碱弱酸盐,会发生水解。
易错点
无法从二维图中读出所需数据进行分析
6.室温下,下列电解质溶液叙述正确的是( )
正确答案
解析
25℃时,pH=1的盐酸浓度为0.1mol/L,pH=11的氨水溶液浓度远大于0.001mol/L,故若1 mL pH=1的盐酸与100 mL pH=11的氨水溶液等体积混合后,溶液的pH>7,A项错误;
将0.2 mol·L-1盐酸与0.1 mol·L-1KAlO2溶液混合后会依次发生下列反应:KAlO2+H2O+HCl=KCl+Al(OH)3↓+H2OAl(OH)3+3HCl=AlCl3+3H2O设体积为VL,则混合溶液中的溶质为0.033VmolAlCl3和0.1V molKCl,所以溶液中离子浓度大小关系为c(OH-)<c(H+)<c(Al3+)<c(K+)<c(Cl-) ,B项正确;
pH相等的① NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,由于NH4HSO4中HSO4-也能电离出氢离子,故①中c(NH4+)最小,①②中NH4+的水解不受抑制和促进,pH相等时,两溶液中c(NH4+)相等,C项错误;
由电荷守恒可知,当0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合后,所得溶液中:c(Na+)+c(H+) = c(HCO3-)+2c(CO32-)+c(OH-) ,D项错误。
考查方向
解题思路
把握住物质在水溶液中的电离平衡和水解平衡,分析具体的反应过程。
易错点
本题容易在离子反应的定量计算上出现错误。
知识点
4.在催化剂作用下,H2O2发生分解,其反应能量随反应的进程变化如下图:下列说法正确的是
正确答案
解析
A.化学反应的吸热或者放热根据反应物与生成物的总能量大小判断,从图像中不难看出生成物的总能量小于反应物总能量,所以该反应是放热反应,故错误。
B.根据盖斯定律,反应热只与反应物和生成物的始末状态有关,与途径无关,所以催化剂不能改变反应热,故错误。
C.过氧化氢的分解不是可逆反应,其次催化剂不能影响化学平衡,因此不能改变转化率,故错误。
D.催化剂通过降低活化能加快化学反应速率,故正确。
考查方向
解题思路
认真辨认图形横坐标、纵坐标的意义,以及曲线变化规律、趋势,应用已有的结论加以解释、验证。
易错点
催化剂不能改变平衡,不影响产率
知识点
扫码查看完整答案与解析