- 重要的还原剂
- 共25题
6.下列关于有机物的叙述中有( )句话是正确的。
①福尔马林、酒精均可使蛋白质变性
②石油的炼制过程不都是化学变化
③麦芽糖、淀粉水解的最终产物均为葡萄糖
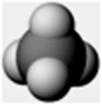
④甲烷分子的比例模型:
⑤天然气和石蜡的主要成分都是碳氢化合物
⑥用饱和氢氧化钠溶液除去乙酸乙酯中的少量乙酸
⑦煤的液化和气化是物理变化
⑧苯和乙烯两种物质均能使溴水和酸性高锰酸钾溶液褪色,且反应类型也相同
正确答案
解析
①福尔马林、苯酚、酒精均可使蛋白质发生变性;
②石油的分馏过程属于物理变化;
③麦芽糖、淀粉水解的最终产物均为葡萄糖;
④甲烷分子的比例模型:
⑤天然气和石蜡的主要成分都是烃;
⑥饱和碳酸钠溶液与乙酸反应,降低乙酸乙酯的溶解度;
⑦煤的液化是化学变化;
⑧酸性高锰酸钾溶液氧化乙烯气体生成二氧化碳。
考查方向
解题思路
①福尔马林、苯酚、酒精均可使蛋白质发生变性;
②石油的分馏过程属于物理变化;
③麦芽糖、淀粉属于糖类;
④甲烷分子的比例模型:
⑤天然气和石蜡的主要成分都是烃;
⑥饱和碳酸钠溶液降低乙酸乙酯的溶解度;
⑦煤的液化是化学变化;
⑧酸性高锰酸钾溶液氧化乙烯气体生成二氧化碳。
易错点
有机反应、有机物除杂、性质与用途。
知识点
7.《新修本草
正确答案
解析
“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑠璃…烧之赤色…”,青矾是绿色,经煅烧后,分解成粒度非常细而活性又很强的Fe2O3超细粉末为红色,
A为蓝色晶体,
B为FeSO4•7H2O是绿色晶体,
C为KAl(SO4)2•12H2O是无色晶体,
D为Fe2(SO4)3•9H2O为黄色晶体,
所以判断“青矾”的主要成分为FeSO4•7H2O,故选B.
考查方向
铁的氧化物和氢氧化物
解题思路
“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑠璃…烧之赤色…”,青矾是绿色,经煅烧后,分解成粒度非常细而活性又很强的Fe2O3超细粉末为红色。
易错点
本题容易混淆亚铁盐和铁盐转化的颜色变化,容易理解错题给信息。
知识点
6.在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+N2(g) 2NH3(g) △H<0。t1时刻到达平衡后,在t2时刻改变某一条件,其反应过程如下图所示。下列说法正确的是()
正确答案
解析
A.t2时逆反应速率增大,说明是使用了催化剂,化学平衡常数只与温度有关,温度不变,化学平衡常数不变,所以化学平衡常数:KI=KII;
B.由于II过程达到平衡后,化学平衡逆向移动,当达到平衡时逆反应速率小于开始时的正反应速率,所以平衡时其中NH3的体积分数:I<II;
C.由于容器的容积不变,反应混合物都是气体,所以在任何时刻气体的密度都不变;
D.若t2时刻改变的条件是向密闭容器中加H2和N2混合气,则反应的正反应速率应该突然增大,逆反应速率不变,这与图像不吻合。
考查方向
解题思路
A.化学平衡常数只与温度有关:KI=KII;
B.由于II过程达到平衡后,化学平衡逆向移动;
C.由于容器的容积不变,在任何时刻气体的密度都不变;
D.反应的正反应速率应该突然增大,逆反应速率不变。
易错点
容器的容积不变,在任何时刻气体的密度都不变。
知识点
6.常温下,下列有关稀溶液中离子浓度的说法正确的是
正确答案
解析
A:(NH4)2SO4电离出来的NH4+是最多的, NH4HSO4中H+的存在抑制了NH4+的水解,而
NH4Al(SO4)2中Al3+水解也会抑制NH4+的水解,NH4+与Al3+相互抑制水解,NH4CL没有抑制水解的
物质存在,也没有促进水解的物质存在,所以正确的排序应该为②>③>④>①
B:由NaHS化学式可知,Na元素与S元素为1:1关系,故有c(Na+)= c(H2S),水解:HS-+H2O⇌H2S+OH-
H2O⇌H++OH-,c(OH-)= c(H+)+ c(H2S),电荷守恒式:c(Na+)+ c(H+)= c(OH-)+ 2c(HS-),可推出c(Na+)+
c(OH-)= c(H+)+ 2c(H2S),对
C:NH4Cl溶液中,c(Cl-) 是最大的为:0.1 mol /L,而此溶液中离子浓度最小的是水电离生成的H+
和OH-为1×10-9,所以C错。
D: CH3COONa水解生成CH3COOH,CH3COOH会抑制水的电离,所以CH3COONa中由水电离出来的
H+浓度减小,而NH3· H2O是弱碱,弱碱电离出来的离子浓度不大,对水的电离的抑制不如CH3COONa
的强,③>④,故D错
考查方向
解题思路
溶液中离子水解和是否存在其它离子抑制其水解,找到化学反应中关键元素的对应守
恒关系;正确分析溶液中存在的离子,尤其注意水的电离,判断离子的浓度就比较简单了;根据离
子的水解方程式判断溶液中水电离的H+浓度就比较容易了;
易错点
不能正确分析各种离子水解过程和程度,不能正确判断化学反应守恒的标志元素,以及
溶液中的电荷守恒、质子守恒、物料守恒的的应用错误和概念的理解失误,盐类水解后离子浓度的
变化情况的判断失误
知识点
7. N2 (g) 与H2 (g) 在铁催化剂表面经历如下过程生成NH3 (g) :
下列说法正确的是
正确答案
解析
A、I 中破坏的是非极性键;
B、Ⅵ中是 NH2和H 生成 NH3;
C、三个过程均是能量降低,所以是放热过程;
D、由图可知反应物的能量高于生成物的能量,是放热反应,因此△H < 0。
考查方向
解题思路
判断出反应物和生成物,然后判断出化学键成断键能量的+、-,基于图形数据进行计算。
易错点
化学键成断键能量的+、-。
知识点
扫码查看完整答案与解析