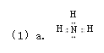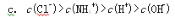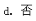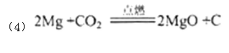- 氯、溴、碘的性质实验
- 共3题
9.美日科学家因研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖.有机合成常用的钯/活性炭催化剂长期使用,催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,故需对其回收再利用。一种由废催化剂制取氯化钯(PdCl2)的工艺流程如下:
(1)甲酸在反应中的作用是_________(选填:“氧化剂”或“还原剂”);
(2)加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素的存在形式是_________(写化学式);
(3)王水是浓硝酸与浓盐酸按体积比1:3混合而成的,钯在王水中溶解的过程中有化合物A和一种无色、有毒气体B生成。
①气体B的化学式为_______,
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%.则A的化学式为__________;
(4)700℃“焙烧1”的目的是____________________,550℃“焙烧2”的目的是______________.
正确答案
(1)还原剂
(2)Fe(OH)3
(3)NO;H2PdCl4
(4)脱氨[或“将Pd(NH3)2Cl2转变为PdCl2”]
解析
解析已在路上飞奔,马上就到!
知识点
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:氧化性:



(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是_________(用化学式表示);CCl4中显紫红色的物质是_____________(用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为____________、____________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。
写出潮湿环境下KI与氧气反应的化学方程式:_____________________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是___________________。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+。
正确答案
(1)①Fe(SCN)3; 



(2)4KI+O2+2H2O
(3)AC。
(4)方法Ⅰ:取适量食盐,加水溶解,滴加足量氯水(或H2O2),再加KSCN溶液至过量,若显血红色说明有Fe2+。
方法Ⅱ:取适量食盐,加水溶解,加入K3Fe(CN)3溶液,有蓝色沉淀说明有Fe2+。
解析
(1)滴入KSCN溶液显红色,说明原样品中含铁离子,红色物质可认为是Fe(SCN)3;既然含有铁离子,那么具有较强还原性的碘离子一定不存在;加入KI之后,IO3- (H+)和Fe3+都可以氧化I-,发生的离子反应分别是IO3- +5I-+6H+

(2)KI被空气中的氧气氧化为单质碘4KI+O2+2H2O=4KOH+2I2。KI3在受热(或潮湿)条件下产生I2和KI,KI被氧气氧化,I2易升华,不但造成碘的流失,还会伤害到人、污染环境,故KI3・H2O作为食盐加碘剂不合适。
(3)硫代硫酸钠可将I2还原为I-,A项可选;B项中的铝盐对人体有害;D项的亚硝酸钠属于强致癌品;根据题干给定信息,欲防碘元素流失,应在碱性条件下,将其转化为碘化钾、碘酸钾,所以应选AC。
(4)取少量该盐样品,加蒸馏水制成溶液,取少量滴入KSCN溶液,没有明显现象;继续滴入双氧水或者新制氯水,则溶液立刻变成红色。
知识点
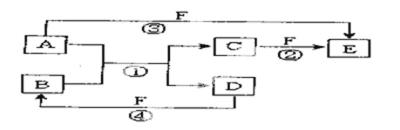
26.A—F有如图所示的转化关系(反应条件未标出),已知反应①是置换反应。请回答下列问题:
(1)若B是黄绿色气体,C、F是空气的主要成分,A、D相遇有白烟生成。
a.写出A的电子式 。
b.写出反应①中直接产生白烟的化学方程式为 。
c. A、D相遇形成的白烟所形成的水溶液中所有离子的浓度由大到小的顺序为
(用离子符号表示)。
d. 有同学模仿排饱和食盐水收集氯气的方法,想用排饱和白烟的水溶液的方法收集A气体。你认为能否达到目的? (填“能”或“否”),理由是 。
(2)若A、D、F都是非金属单质,A、D所含元素同主族,A、F所含元素同周期,则写出反应①的化学方程式为 ;说出B的一个重要用途 。
(3)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行。若C的溶液在空气中暴露一定时间后,要证明该溶液中的阳离子未被氧化完的实验方法是
。
(4)若A、D是常见单质, A的原子序数是D的2倍, D原子的最外层电子数是A的2倍,反应③④中都有红棕色气体生成。则反应①的化学方程式为 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析