- 氨的化学性质
- 共17题
19.高纯度的氢氧化镁广泛应用于医药、电力等领域。镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如下:
己知1:溶液I中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子
2:几种金属阳离子的氢氧化物沉淀时的pH如下表所示:
(1)Mg在周期表中的位置________________,Si的原子结构示意图为______________。
(2)向溶液I中加入X的作用是______________________________________________。
(3)向溶液I中加入的两种试剂先后顺序是__________________(填化学式)。
(4)加入H2O2溶液反应的离子方程式是___________________________________。
(5)下图是溶液Ⅱ中Mg2+转化率随温度t的变化示意图:
①向溶液Ⅱ中加入氨水反应的离子方程式是_________________________。
②t1前Mg2+转化率增大的原因是___________________________;t1后Mg2+转化率下降的原因是(用化学方程式表示)________________________________。
正确答案
(1)第三周期ⅡA族
(2)调节溶液pH
(3)H2O2、 MgO [Mg(OH)2或MgCO3]
(4)2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
(5)①Mg2+ + 2NH3·H2O 
②镁离子与氨水反应是吸热反应,升高温度,平衡右移,Mg2+转化率增大
NH3·H2O
解析
液Ⅰ中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子,根据题中提供的各种金属离子沉淀的pH值可知,加入双氧水可以将亚铁离子氧化成铁离子,再加入试剂X主要作用是调节溶液pH值,使铁离子沉淀,可以加氧化镁或氢氧化镁等,过滤后在滤液中加入氨水使溶液中镁离子沉淀,得氢氧化镁沉淀,由于要通过使铁离子沉淀的方法除去铁,所以要先氧化再沉淀,根据Mg2+转化率随温度t的变化示意图可知,由于氨水与镁离子反应生成氢氧化镁的反应是吸热反应,所以升高温度,镁离子的转化率增大,但随着温度的升高,氨气在水中的溶解度减小,氨水的浓度减小,会导致Mg2+转化率减小,
(1)Mg在周期表中的位置第三周期ⅡA族,Si的原子结构示意图为
(2)根据上面的分析可知,向溶液Ⅰ中加入X的作用是调节溶液pH;
(3)根据上面的分析可知,要先氧化再沉淀,所以向溶液Ⅰ中加入的两种试剂先后顺序是H2O2、MgO;
(4)根据上面的分析可知,加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O;
(5)①向溶液Ⅱ中加入氨水与镁离子反应生成氢氧化镁沉淀,反应的离子方程式是 Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+;
②根据上面的分析可知,t1前Mg2+转化率增大的原因是反应是吸热反应,升高温度,Mg2+转化率增大,平衡右移;t1后Mg2+转化率下降的原因是氨气在水中的溶解度减小,氨水的浓度减小,反应的方程式为 NH3•H2O 
考查方向
解题思路
Mg在周期表中的位置第三周期ⅡA族,Si的原子结构示意图为
易错点
本题考查物质制备方案,涉及物质分离提纯、离子沉淀的条件选择、化学平衡的影响因素、离子方程式的书写、沉淀转化的原理应用,侧重于学生的分析能力和实验能力的考查,难度中等。
知识点
无色气体N204是一种强氧化剂,为重要的火箭推进剂之一。N204与N02转换的热化学方程式为:N204(g) 
24.将一定量N204投入固定容积的真空容器中,下述现象能说明反应达到平衡的是________________
a.v正(N204)=2 v逆(N02)
b.体系颜色不变
c.气体平均相对分子质量不变
d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,则混合气体颜色______________(填“变深”、“变浅”或“不变”),判断理由____。
25.平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如:p(NO2)=p总×x(NO2)。写出上述反应平衡常数Kp表达式 (用p总、各气体物质的量分数x表示);影响Kp的因素____。
26.上述反应中,正反应速率v正=k正-p(N204),逆反应速率v逆=k逆.P2(NO2),其中k正、k逆为速率常数,则Kp为________________(以k正、k逆表示)。若将一定量N204投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×l04 s-1,当N204分解10%时,v正=____kPa.s-1;
27.真空密闭容器中放人一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N204分解百分率为a。保持温度不变,向密闭容器中充人等量N2O4,维持总压强在2p0条件下分解,则N204的平衡分解率的表达式为 。
正确答案
bc; 深 正反应是吸热反应,其他条件不变,温度升高平衡正向移动,c(NO2)增加,颜色加深
解析
无色气体N204是一种强氧化剂,为重要的火箭推进剂之一。N204与N02转换的热化学方程式为:N204(g) 
考查方向
易错点
平衡常数K的计算。
正确答案
p总·x2(NO2)/ x(N2O4) 其他合理答案亦可 温度
解析
平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如:p(NO2)=p总×x(NO2)。写出上述反应平衡常数Kp表达式 )p总·x2(NO2)/ x(N2O4);影响Kp的因素温度。
考查方向
易错点
平衡常数K的计算。
正确答案
k正/k逆 3.9×106
解析
上述反应中,正反应速率v正=k正-p(N204),逆反应速率v逆=k逆.P2(NO2),其中k正、k逆为速率常数,则Kp为k正/k逆以k正、k逆表示)。若将一定量N204投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×l04 s-1, 当N204分解10%时,v正=3.9×106kPa.s-1;
考查方向
易错点
平衡常数K的计算。
正确答案
(α2/2-α2)1/2
解析
真空密闭容器中放人一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N204分解百分率为a。保持温度不变,向密闭容器中充人等量N2O4,维持总压强在2p0条件下分解,则N204的平衡分解率的表达式为(α2/2-α2)1/2
考查方向
本题主要考查了盖斯定律,化学平衡影响因素、平衡常数K。
易错点
平衡常数K的计算。
工业上用活性炭吸附海带提碘后废水中的I-制取I2,其流程如下图:
(1)向废水中加入NaNO2并调节pH<4,写出反应的离子方程式__________________。
(2)用活性炭吸附生成的单质碘的目的是__________________________,用浓、热NaOH洗脱吸附的碘的化学方程式为___________________________________。
(3)从调节pH后所得的溶液中获取碘,工业上可用热空气吹出,其原因是___________;若取少量该溶液在实验室中分离得到单质碘,需要进行的操作为__________________。
(4)流程中生成的NO尾气有毒,工业上将其与O2按一定比例通入NaOH制备NaNO2,写出反应的化学方程式:________________________________。
(5)工业上虚框内流程还可用如右图操作代替,评价右图流程的优点___________________________(写出一条)。
正确答案
(1)2NO2-+ 4H++ 2I- → 2NO + I2 + 2H2O
(2)富集单质碘; 3I2 + 6NaOH → NaIO3+ 5NaI+ 3H2O
(3)单质碘在水中溶解度小,易升华; 萃取 分液 蒸馏
(4)4NaOH+ O2+ 4NO → 4NaNO2+ 2H2O
(5)减少了化学药品的投入量,使成本大大降低。(或生产环节减少;或药品对设备无腐蚀性等)
解析
略
知识点
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐N。下列有关说法错误的是()
正确答案
解析
略
知识点
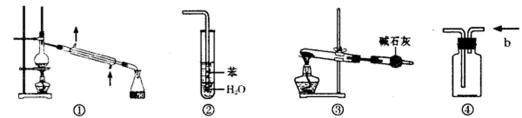
13.实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析