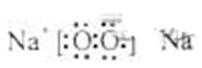- 元素周期律和元素周期表的综合应用
- 共63题
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0:Q与X同主族:Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) 。
(2)X与Y能形成多种化合物其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) 。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:
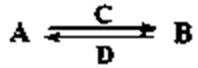
其中,C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。A、B浓度均为0.1mol·L-1的混合溶液中,离子浓度由大到小的顺序是 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 。
正确答案
见解析
解析
解析:该题以周期律和周期表为基础知识,考查元素推断、重要元素化合物的性质、化学用语、电解质溶液中离子浓度大小比较等重要知识。
(1) 根据短周期元素、X、Y元素的X、Y两元素最高正价与最低负价之和均为0;推知X Y元素分别为H和C,Q与X同主族推知Q为Na元素,Z、R分别是地壳中含量最高的非金属元素和金属元素,推知Z为O元素,R为Al元素。
原子半径大小顺序为Na>Al>C>O>H
(2)C和H形成的物质是有机化合物,含极性键又含非极性键,分子质量最小的只能是
C2H2
(3)C溶于水显酸性的气体只能是CO2,D是淡黄色固体,只能是过氧化钠
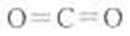
①B为两性不溶物,AB均由三种元素组成,根据转化关系A为NaAlO2,
B为Al(OH)3由A转化为B的离子方程式AlO2-+2H2O+CO2=Al(OH)3+HCO3-或
2AlO2-+3 H2O+CO2=2 Al(OH)3+CO32-
②A由三种元素组成,B由四种元素组成,A、B溶液均显碱性,A是Na2CO3,B是NaHCO3.A显碱性的原因是CO32-的水解。水解的离子方程式为CO32-+H2O
知识点
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
(1)W位于元素周期表第 周期第 族;W的原子半径比X的 (填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”); 


(3)震荡下,向Z单质与盐酸反应后的无色溶液中滴加

(4)在25°、101



正确答案
(1)三 NA 小
(2)小 分子间作用力(范德华力) 甲醛(甲酸)
(3)先产生白色沉淀,后沉淀溶解 Si + 4HF = SiF4
(4)2Al + 3 O2 =Al2O3 △H= -1675KJmol
解析
X的最高价氧化对应的水化物为H2XO3,可以确定X为+4价,故可能为C、Si;Y是地壳中含量最高的为O,Z、最外层电子为3s23p1,为Al;W质子数为28-14=14为Si,故综上有X、Y、Z、W分别为C、O、Al、Si。
知识点
图7是部分周期元素化合价与原子序数的关系图,下列说法正确的是
正确答案
解析
从图看知:X为O,Y为Na,Z为Al,W为S,R为Cl。A.应该是Y>Z>X。C.硫酸为共价化合物。
知识点
短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是
正确答案
解析
由“X元素的原子内层电子数是最外层电子数的一半”可推出X为C,因此Y为O,Z为Si,W为S,Q为Cl。A选项:Na和S可形成类似于Na2O 2 的Na2S2。Z与Y组成的物质是SiO2,SiO2是原子晶体,熔融时不能导电。C选项:S得电子能力比Cl弱。D选项:C、O元素都能形成多种同素异形体。
知识点
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物


(1)A在周期表中的位置是_______,写出一种工业制备单质F的离子方程式_______。(每空2分)
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为_______(1分),其水溶液与F单质反应的化学方程式为_______(2分),在产物中加入少量KI,反应后加人
(3)由这些元素组成的物质,其组成和结构信息如下表:
a的化学式为_______(1分);b的化学式为_______(2分);c的电子式为_______(1分);d的晶体类型是_______(1分)。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过_______(1分)键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为_______(1分)。
正确答案
(1)

(2)纯碱(或苏打)
(3)



(4)氢;正四面体
解析
略。
知识点
扫码查看完整答案与解析