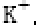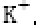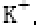- 晶胞的计算
- 共6题
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式________;F离子电子排布式________。
(2)写出X的化学式________和化学名称________。
(3)写出X涉及化工生产中的一个化学方程式________。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:________。
(5)CE、FA的晶格能分别为786 kJ·mol-1 l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是:________。
(6)F与B可形成离子化合物,其晶胞结构如图所示: F与B形成离子化合物的化学式为________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是________(只要求列出算式)。
正确答案
(1)2s22p4;1s22s22p63s23p6
(2)Na3AlF6;六氟合铝酸钠
(3)2Al2O3(融熔)
(4)Al2O3为离子晶体而AlCl3为分子晶体
(5)CaO晶体中Ca2+、 O2- 的带电量大于NaCl晶体中Na+、Cl-的带电量。
(6)Ca F2 (1分);
解析
由A原子L层上有2对成对电子,可知A原子的电子排布为2S22s22p4,为氧元素;A与B同周期,且B原子序数大于A的,故B必为氟元素;则可根据C3DB6为离子晶体,且B、C、D的简单离子核外电子排布相同,结合化合价可推出C、D分别钠元素和铝元素,X为Na3AlF6;由CE、FA为电子数相同的离子晶体可推出二者分别为NaCl和CaO。
(6)由图中看出,每个晶胞中含有Ca原子个数8×+6×=4,F原子全部在该晶胞内部,故该晶胞含有F原子个数为8,其化学式为CaF2;取一个晶胞,其质量为,则其体积为质量除以密度,即
知识点
亚硝酸钠(NaNO2)易溶于水,微溶于乙醚,是常用的食品发色剂
(1)第一电离能:N ___O(填“<”、“>”或“=”);NO2-的空间构型为____
(2)亚硝酸钠在3200C会分解生成氧化钠、一氧化二氮等物质,该反应的化学方程式为____
(3)亚硝酸钠是亚硝酸的钠盐。HNO2的结构如图所示,则HNO2分子中有___个
HNO2的酸性比HN03弱是因为_____
(4)亚硝基钻钠

①基态
②用亚硝酸钻钠检验f的离子方程式是
③金属钻的堆积方式如图所示,若一个钻原子的半径为,,则晶胞的体积V(晶胞)=__
正确答案
(1)>(1分);V型或角形(1分)
(2)
(3)3(2分)
(4)
解析
略
知识点
氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为_______个。
(2)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为_______。

(3)H+可与H2O形成H3O+,H3O+原子采用_______杂化。H3O+中H-O-H键角比H2O中H-O-H键角大,原因为_______。
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为a g·cm-3, NA表示阿伏伽德罗常数,则CaO晶胞体积为_______cm3
正确答案
(1) 2
(2)O—H键、氢键、范德华力;

(3)sp3;H2O中O原子有两对孤对电子,H3O+中O原子只有一对故对电子,排斥力较小
(4)
解析
(1)氧元素的基态核外电子排布式为:1s22s22p4,4个电子在三个轨道中排布,故未成对的电子个数是两个。
(2)化学键是强烈的相互作用;氢键的作用力比化学键弱,但比范德华力的作用力要强。

(3) H3O+的空间构型为三角锥型,故O原子的杂化方式为sp3;H3O+中O原子只有一对故对电子,排斥力较小,使得键角变大。
(4)根据NaCl的晶胞可知,一个晶胞含有4个CaO,设晶胞的体积为V,则:

知识点
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 ,第一电离能最小的元素是 (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为 

(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构如图
三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式: 。
正确答案
(1)
(2)
(3)
(4)
(5)
解析
略
知识点
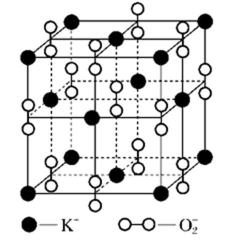
13.高温下,超氧化钾(KO2)晶体结构与NaCl相似,其晶体结构的一个基本重复单元如图所示,已知晶体中氧的化合价可看作部分为0价,部分为-2价。则下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析