- 化学键
- 共20题
4.下列各组物质的熔点均与所含化学键的键能有关的是
正确答案
解析
A.CaO是离子化合物, 熔化断裂离子键,而 CO2在固态时是分子品体, 熔化破坏的是分子间作用力,与化学键无关,错误; B.NaCl是离子化合物, 熔化断裂离子键,而HCl在固态时是分子晶体, 熔化破坏的是分子间作用力, 与化学键无关,错误; C.SiC和SiO2都是原子晶体, 熔化断裂的是共价键, 与化学键有关,正确; D.Cl2和I2在固态时都是分子晶体, 熔化断裂的是分子间作用力, 与化学键无关,错误。
考查方向
解题思路
离子晶体融化破坏离子键,分子晶体融化破坏分子间作用力,原子晶体融化破坏共价键,金属晶体融化破坏金属键。
易错点
不了解原子晶体融化破坏共价键。
知识点
6.将Na、Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克服相同类型作用力的物质有( )
正确答案
解析
Na为金属晶体,熔化时克服金属键,Na2O、NaOH、Na2S、Na2SO4为离子晶体,熔化时克服离子键.
故选C.
考查方向
解题思路
Na、Na2O、NaOH、Na2S、Na2SO4中Na为金属晶体,Na2O、NaOH、Na2S、Na2SO4为离子晶体,以此解答.
易错点
本题考查晶体类型的判断和化学键键的判断,为高频考点,侧重于学生的分析能力和基本概念的考查,题目难度不大,注意晶体类型的分类和性质的区别.
知识点
张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
33.As原子的核外电子排布式为 。
1.晶胞计算是晶体考查的重要知识点之一,也是考查学生分析问题、解决问题能力的较好素材。晶体结构的计算常常涉及如下数据:晶体密度、NA、M、晶体体积、微粒间距离、微粒半径、夹角等,密度的表达式往往是列等式的依据。解决这类题,一是要掌握晶体“均摊法”的原理,二是要有扎实的立体几何知识,三是要熟悉常见晶体的结构特征,并能融会贯通,举一反三。
34.P和S是同一周期的两种元素,P的第一电离能比S大,原因是

36.Na3AsO4中含有的化学键类型包括 ;AsO43-的空间构型为 ,As4O6的分子结构如图所示,则在该化合物中As的杂化方式是 。
37.化合物NH5中的所有原子最外层都满足稳定结构,则NH5是 晶体。
38.白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。己知晶胞的边长为a cm,阿伏加德罗常数为
正确答案
1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3
解析
As原子的核外电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3。
考查方向
本题主要考查了考查核外电子排布、杂化轨道、共价键、配位键以及晶胞分析与计算。
解题思路
1、电子排布图
它们有各自不同的侧重点:
(1)结构示意图:能直观地反映核内的质子数和核外的电子层数及各层上的电子数。
(2)核组成式:如8(16)O,侧重于表示原子核的结构,它能告诉我们该原子核内的质子数和核外电子数以及质量数,但不能反映核外电子的排布情况。
(3)电子排布式:能直观地反映核外电子的能层、能级和各能级上的电子数,但不能表示原子核的情况,也不能表示各个电子的运动状态。
(4)电子排布图:能反映各轨道的能量的高低,各轨道上的电子分布情况及自旋方向。
(5)价电子排布式:如Fe原子的电子排布式为1s22s22p63s23p63d64s2,价电子排布式为3d64s2。价电子排布式能反映基态原子的能层数和参与成键的电子数以及最外层电子数。
2、晶胞计算的思维方法
1.晶胞计算是晶体考查的重要知识点之一,也是考查学生分析问题、解决问题能力的较好素材。晶体结构的计算常常涉及如下数据:晶体密度、NA、M、晶体体积、微粒间距离、微粒半径、夹角等,密度的表达式往往是列等式的依据。解决这类题,一是要掌握晶体“均摊法”的原理,二是要有扎实的立体几何知识,三是要熟悉常见晶体的结构特征,并能融会贯通,举一反三。
2.“均摊法”原理
特别提醒①在使用均摊法计算晶胞中微粒个数时,要注意晶胞的形状,不同形状的晶胞,应先分析任意位置上的一个粒子被几个晶胞所共有,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心依次被6、3、4、2个晶胞所共有。
②在计算晶胞中粒子个数的过程中,不是任何晶胞都可用均摊法。
3.晶体微粒与M、ρ之间的关系
若1个晶胞中含有x个微粒,则1 mol晶胞中含有x mol微粒,其质量为xM g(M为微粒的相对“分子”质量);1个晶胞的质量为ρa3 g(a3为晶胞的体积),则1 mol晶胞的质量为ρa3NA g,因此有xM=ρa3NA。
易错点
1、价电子排布式。
2、配位键以及晶胞分析与计算。
正确答案
3.晶体微粒与M、ρ之间的关系
若1个晶胞中含有x个微粒,则1 mol晶胞中含有x mol微粒,其质量为xM g(M为微粒的相对“分子”质量);1个晶胞的质量为ρa3 g(a3为晶胞的体积),则1 mol晶胞的质量为ρa3NA g,
因此有xM=ρa3NA。
解析
P和S是同一周期的两种元素,P的p亚层是半充满状态,比较稳定,所以第一电离能比硫的大。
考查方向
本题主要考查了考查核外电子排布、杂化轨道、共价键、配位键以及晶胞分析与计算。
解题思路
1、电子排布图
它们有各自不同的侧重点:
(1)结构示意图:能直观地反映核内的质子数和核外的电子层数及各层上的电子数。
(2)核组成式:如8(16)O,侧重于表示原子核的结构,它能告诉我们该原子核内的质子数和核外电子数以及质量数,但不能反映核外电子的排布情况。
(3)电子排布式:能直观地反映核外电子的能层、能级和各能级上的电子数,但不能表示原子核的情况,也不能表示各个电子的运动状态。
(4)电子排布图:能反映各轨道的能量的高低,各轨道上的电子分布情况及自旋方向。
(5)价电子排布式:如Fe原子的电子排布式为1s22s22p63s23p63d64s2,价电子排布式为3d64s2。价电子排布式能反映基态原子的能层数和参与成键的电子数以及最外层电子数。
2、晶胞计算的思维方法
1.晶胞计算是晶体考查的重要知识点之一,也是考查学生分析问题、解决问题能力的较好素材。晶体结构的计算常常涉及如下数据:晶体密度、NA、M、晶体体积、微粒间距离、微粒半径、夹角等,密度的表达式往往是列等式的依据。解决这类题,一是要掌握晶体“均摊法”的原理,二是要有扎实的立体几何知识,三是要熟悉常见晶体的结构特征,并能融会贯通,举一反三。
2.“均摊法”原理
特别提醒①在使用均摊法计算晶胞中微粒个数时,要注意晶胞的形状,不同形状的晶胞,应先分析任意位置上的一个粒子被几个晶胞所共有,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心依次被6、3、4、2个晶胞所共有。
②在计算晶胞中粒子个数的过程中,不是任何晶胞都可用均摊法。
3.晶体微粒与M、ρ之间的关系
若1个晶胞中含有x个微粒,则1 mol晶胞中含有x mol微粒,其质量为xM g(M为微粒的相对“分子”质量);1个晶胞的质量为ρa3 g(a3为晶胞的体积),则1 mol晶胞的质量为ρa3NA g,因此有xM=ρa3NA。
易错点
1、价电子排布式。
2、配位键以及晶胞分析与计算。
正确答案
P的p亚层是半充满状态,比较稳定,所以第一电离能比硫的大。
考查方向
本题主要考查了考查核外电子排布、杂化轨道、共价键、配位键以及晶胞分析与计算。
解题思路
1、电子排布图
它们有各自不同的侧重点:
(1)结构示意图:能直观地反映核内的质子数和核外的电子层数及各层上的电子数。
(2)核组成式:如8(16)O,侧重于表示原子核的结构,它能告诉我们该原子核内的质子数和核外电子数以及质量数,但不能反映核外电子的排布情况。
(3)电子排布式:能直观地反映核外电子的能层、能级和各能级上的电子数,但不能表示原子核的情况,也不能表示各个电子的运动状态。
(4)电子排布图:能反映各轨道的能量的高低,各轨道上的电子分布情况及自旋方向。
(5)价电子排布式:如Fe原子的电子排布式为1s22s22p63s23p63d64s2,价电子排布式为3d64s2。价电子排布式能反映基态原子的能层数和参与成键的电子数以及最外层电子数。
2、晶胞计算的思维方法
1.晶胞计算是晶体考查的重要知识点之一,也是考查学生分析问题、解决问题能力的较好素材。晶体结构的计算常常涉及如下数据:晶体密度、NA、M、晶体体积、微粒间距离、微粒半径、夹角等,密度的表达式往往是列等式的依据。解决这类题,一是要掌握晶体“均摊法”的原理,二是要有扎实的立体几何知识,三是要熟悉常见晶体的结构特征,并能融会贯通,举一反三。
2.“均摊法”原理
特别提醒①在使用均摊法计算晶胞中微粒个数时,要注意晶胞的形状,不同形状的晶胞,应先分析任意位置上的一个粒子被几个晶胞所共有,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心依次被6、3、4、2个晶胞所共有。
②在计算晶胞中粒子个数的过程中,不是任何晶胞都可用均摊法。
3.晶体微粒与M、ρ之间的关系
若1个晶胞中含有x个微粒,则1 mol晶胞中含有x mol微粒,其质量为xM g(M为微粒的相对“分子”质量);1个晶胞的质量为ρa3 g(a3为晶胞的体积),则1 mol晶胞的质量为ρa3NA g,因此有xM=ρa3NA。
易错点
1、价电子排布式。
2、配位键以及晶胞分析与计算。
正确答案
大;NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力,导致NH4+中H-N-H的键角比NH3中大。
解析
NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力,导致NH4+中H-N-H的键角比NH3中大。
考查方向
本题主要考查了考查核外电子排布、杂化轨道、共价键、配位键以及晶胞分析与计算。
解题思路
1、电子排布图
它们有各自不同的侧重点:
(1)结构示意图:能直观地反映核内的质子数和核外的电子层数及各层上的电子数。
(2)核组成式:如8(16)O,侧重于表示原子核的结构,它能告诉我们该原子核内的质子数和核外电子数以及质量数,但不能反映核外电子的排布情况。
(3)电子排布式:能直观地反映核外电子的能层、能级和各能级上的电子数,但不能表示原子核的情况,也不能表示各个电子的运动状态。
(4)电子排布图:能反映各轨道的能量的高低,各轨道上的电子分布情况及自旋方向。
(5)价电子排布式:如Fe原子的电子排布式为1s22s22p63s23p63d64s2,价电子排布式为3d64s2。价电子排布式能反映基态原子的能层数和参与成键的电子数以及最外层电子数。
2、晶胞计算的思维方法
1.晶胞计算是晶体考查的重要知识点之一,也是考查学生分析问题、解决问题能力的较好素材。晶体结构的计算常常涉及如下数据:晶体密度、NA、M、晶体体积、微粒间距离、微粒半径、夹角等,密度的表达式往往是列等式的依据。解决这类题,一是要掌握晶体“均摊法”的原理,二是要有扎实的立体几何知识,三是要熟悉常见晶体的结构特征,并能融会贯通,举一反三。
2.“均摊法”原理
特别提醒①在使用均摊法计算晶胞中微粒个数时,要注意晶胞的形状,不同形状的晶胞,应先分析任意位置上的一个粒子被几个晶胞所共有,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心依次被6、3、4、2个晶胞所共有。
②在计算晶胞中粒子个数的过程中,不是任何晶胞都可用均摊法。
3.晶体微粒与M、ρ之间的关系
若1个晶胞中含有x个微粒,则1 mol晶胞中含有x mol微粒,其质量为xM g(M为微粒的相对“分子”质量);1个晶胞的质量为ρa3 g(a3为晶胞的体积),则1 mol晶胞的质量为ρa3NA g,因此有xM=ρa3NA。
易错点
1、价电子排布式。
2、配位键以及晶胞分析与计算。
正确答案
离子键、共价键;正四面体;sp3。
解析
Na3AsO4中含有的化学键类型包括离子键(Na与AsO)、共价键(AsO4中As和O);AsO43-的空间构型为正四面体,题目已经给出As4O6的分子结构,分析可知该化合物中As的杂化方式是sp3。
考查方向
本题主要考查了考查核外电子排布、杂化轨道、共价键、配位键以及晶胞分析与计算。
解题思路
1、电子排布图
它们有各自不同的侧重点:
(1)结构示意图:能直观地反映核内的质子数和核外的电子层数及各层上的电子数。
(2)核组成式:如8(16)O,侧重于表示原子核的结构,它能告诉我们该原子核内的质子数和核外电子数以及质量数,但不能反映核外电子的排布情况。
(3)电子排布式:能直观地反映核外电子的能层、能级和各能级上的电子数,但不能表示原子核的情况,也不能表示各个电子的运动状态。
(4)电子排布图:能反映各轨道的能量的高低,各轨道上的电子分布情况及自旋方向。
(5)价电子排布式:如Fe原子的电子排布式为1s22s22p63s23p63d64s2,价电子排布式为3d64s2。价电子排布式能反映基态原子的能层数和参与成键的电子数以及最外层电子数。
2、晶胞计算的思维方法
1.晶胞计算是晶体考查的重要知识点之一,也是考查学生分析问题、解决问题能力的较好素材。晶体结构的计算常常涉及如下数据:晶体密度、NA、M、晶体体积、微粒间距离、微粒半径、夹角等,密度的表达式往往是列等式的依据。解决这类题,一是要掌握晶体“均摊法”的原理,二是要有扎实的立体几何知识,三是要熟悉常见晶体的结构特征,并能融会贯通,举一反三。
2.“均摊法”原理
特别提醒①在使用均摊法计算晶胞中微粒个数时,要注意晶胞的形状,不同形状的晶胞,应先分析任意位置上的一个粒子被几个晶胞所共有,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心依次被6、3、4、2个晶胞所共有。
②在计算晶胞中粒子个数的过程中,不是任何晶胞都可用均摊法。
3.晶体微粒与M、ρ之间的关系
若1个晶胞中含有x个微粒,则1 mol晶胞中含有x mol微粒,其质量为xM g(M为微粒的相对“分子”质量);1个晶胞的质量为ρa3 g(a3为晶胞的体积),则1 mol晶胞的质量为ρa3NA g,因此有xM=ρa3NA。
易错点
1、价电子排布式。
2、配位键以及晶胞分析与计算。
正确答案
离子
解析
化合物NH5中的所有原子最外层都满足稳定结构,则NH5是离子晶体。
考查方向
本题主要考查了考查核外电子排布、杂化轨道、共价键、配位键以及晶胞分析与计算。
解题思路
1、电子排布图
它们有各自不同的侧重点:
(1)结构示意图:能直观地反映核内的质子数和核外的电子层数及各层上的电子数。
(2)核组成式:如8(16)O,侧重于表示原子核的结构,它能告诉我们该原子核内的质子数和核外电子数以及质量数,但不能反映核外电子的排布情况。
(3)电子排布式:能直观地反映核外电子的能层、能级和各能级上的电子数,但不能表示原子核的情况,也不能表示各个电子的运动状态。
(4)电子排布图:能反映各轨道的能量的高低,各轨道上的电子分布情况及自旋方向。
(5)价电子排布式:如Fe原子的电子排布式为1s22s22p63s23p63d64s2,价电子排布式为3d64s2。价电子排布式能反映基态原子的能层数和参与成键的电子数以及最外层电子数。
2、晶胞计算的思维方法
1.晶胞计算是晶体考查的重要知识点之一,也是考查学生分析问题、解决问题能力的较好素材。晶体结构的计算常常涉及如下数据:晶体密度、NA、M、晶体体积、微粒间距离、微粒半径、夹角等,密度的表达式往往是列等式的依据。解决这类题,一是要掌握晶体“均摊法”的原理,二是要有扎实的立体几何知识,三是要熟悉常见晶体的结构特征,并能融会贯通,举一反三。
2.“均摊法”原理
特别提醒①在使用均摊法计算晶胞中微粒个数时,要注意晶胞的形状,不同形状的晶胞,应先分析任意位置上的一个粒子被几个晶胞所共有,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心依次被6、3、4、2个晶胞所共有。
②在计算晶胞中粒子个数的过程中,不是任何晶胞都可用均摊法。
3.晶体微粒与M、ρ之间的关系
若1个晶胞中含有x个微粒,则1 mol晶胞中含有x mol微粒,其质量为xM g(M为微粒的相对“分子”质量);1个晶胞的质量为ρa3 g(a3为晶胞的体积),则1 mol晶胞的质量为ρa3NA g,因此有xM=ρa3NA。
易错点
1、价电子排布式。
2、配位键以及晶胞分析与计算。
正确答案
16;496/(a3NA)。
解析
白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。己知晶胞的边长为a cm,阿伏加德罗常数为NA mol-l,则该晶胞中含有的P原子的个数为16,该晶体的密度为496/(a3NA)
考查方向
本题主要考查了考查核外电子排布、杂化轨道、共价键、配位键以及晶胞分析与计算。
解题思路
1、电子排布图
它们有各自不同的侧重点:
(1)结构示意图:能直观地反映核内的质子数和核外的电子层数及各层上的电子数。
(2)核组成式:如8(16)O,侧重于表示原子核的结构,它能告诉我们该原子核内的质子数和核外电子数以及质量数,但不能反映核外电子的排布情况。
(3)电子排布式:能直观地反映核外电子的能层、能级和各能级上的电子数,但不能表示原子核的情况,也不能表示各个电子的运动状态。
(4)电子排布图:能反映各轨道的能量的高低,各轨道上的电子分布情况及自旋方向。
(5)价电子排布式:如Fe原子的电子排布式为1s22s22p63s23p63d64s2,价电子排布式为3d64s2。价电子排布式能反映基态原子的能层数和参与成键的电子数以及最外层电子数。
2、晶胞计算的思维方法
1.晶胞计算是晶体考查的重要知识点之一,也是考查学生分析问题、解决问题能力的较好素材。晶体结构的计算常常涉及如下数据:晶体密度、NA、M、晶体体积、微粒间距离、微粒半径、夹角等,密度的表达式往往是列等式的依据。解决这类题,一是要掌握晶体“均摊法”的原理,二是要有扎实的立体几何知识,三是要熟悉常见晶体的结构特征,并能融会贯通,举一反三。
2.“均摊法”原理
特别提醒①在使用均摊法计算晶胞中微粒个数时,要注意晶胞的形状,不同形状的晶胞,应先分析任意位置上的一个粒子被几个晶胞所共有,如六棱柱晶胞中,顶点、侧棱、底面上的棱、面心依次被6、3、4、2个晶胞所共有。
②在计算晶胞中粒子个数的过程中,不是任何晶胞都可用均摊法。
3.晶体微粒与M、ρ之间的关系
若1个晶胞中含有x个微粒,则1 mol晶胞中含有x mol微粒,其质量为xM g(M为微粒的相对“分子”质量);1个晶胞的质量为ρa3 g(a3为晶胞的体积),则1 mol晶胞的质量为ρa3NA g,因此有xM=ρa3NA。
易错点
1、价电子排布式。
2、配位键以及晶胞分析与计算。
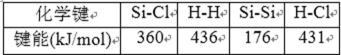
13.由右表提供数据及相关物质结构知识,反应:SiCl4(g)+2H2(g)→Si(s)+4HCl(g),生成1mol
晶体硅的热效应是
正确答案
解析
在晶体硅中,每个硅原子与其它4个硅原子相连,且每个Si-Si键又是被2个硅原子共有,因此,平均每个硅原子占有的共价键数是4×1/2=2个。故反应热为:360×4+436×2-176×2-431×4=236,故吸收236 kJ的热,选A。
考查方向
解题思路
反应热为生成物的键能之和与反应物的键能之和的差值。
易错点
1mol晶体硅中Si-Si键的确定。
知识点
4.化学式为N2H6SO4的某晶体,其晶体类型与硫酸铵相同,则N2H
正确答案
解析
N2H6SO4类比于(NH4)2SO4,可推知是由非金属元素构成的离子晶体,阳离子、阴离子之间是离子键,阳离子、阴离子内还有共价键,没有分子间作用力。故选C。
考查方向
解题思路
“晶体类型与硫酸铵相同”给出了与硫酸铵类比的思路。
易错点
忽视了共价键而错选B。
知识点
14.随着科技的进步,研究和制备物质的手段和途径越来越多,C60、H3、O2+、N5+等已被发现。下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
以下结论可靠的是
正确答案
解析
略
知识点
决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)N、O、S三种元素的第一电离能从大到小的顺序为________。
(2)甲醛(H2C=O)分子碳原子的杂化方式为________用价层电子对互斥理论推断甲醛中H—C—H的键角________120o(填 “>”“<”或“=”)。
(3)科学家通过X射线探明,KCl、MgO、CaO的晶体结构与NaCl的晶体结构相似(图a所示)。KCl、CaO、MgO三种离子晶体熔点从高到低的顺序是________。
设MgO晶胞的边长为acm,则MgO的密度是________g·cm-3(只要求列算式。阿伏伽德罗常数为NA)。
(5)某配合物的分子结构如图b所示,其分子内不含有________(填字母)。
A.离子键
B.共价键
C.金属键
D.配位键
E.氢键
F.Π键
正确答案
(1)N>O>S
(2)sp2;<
(3)MgO>CaO>KCl
(4)160/a3 NA
(5)AC
解析
(1)根据同周期同主族元素性质递变规律判断,同一周期由左向右元素原子的第一电离能呈递增趋势,但氮原子2p轨道为半充满状态,第一电离能比相邻的元素都大;同主族由上到下元素原子的第一电离能逐渐减小,N、O、S三种元素的第一电离能从大到小的顺序为N>O>S。
(2)甲醛(H 2 C=O)分子碳原子的杂化方式为sp2;甲醛(H 2 C=O)分子中氧原子上含有两对孤对电子,对成键电子对有排斥作用,甲醛中H—C—H的键角<120o 。
(3)对于结构相似的离子晶体,晶格能越大晶体的熔点越高;晶格能的高低取决于离子半径和离子所带的电荷,离子半径越小,所带电荷越多,晶格能越大,熔点越高;则KCl、CaO、MgO三种离子晶体熔点从高到低的顺序是MgO>CaO>KCl。
(4)根据MgO晶胞结构利用切割法分析知,1mol晶胞中含有4molMgO,质量为160g,晶胞的边长为acm,则1mol晶胞的体积为a3NAcm3则MgO的密度是160/a3NAg·cm-3 。
(5)根据配合物的分子结构判断,其分子内不含有离子键和金属键,选AC。
知识点
元素之间通过不同的化学键可以组成不同的晶体和化合物。有关化学键与晶体的说法正确的是
正确答案
解析
略
知识点
6.实现下列变化时,需克服相同类型作用力的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析