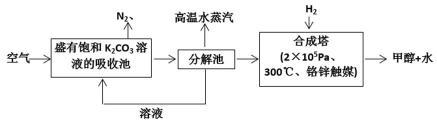
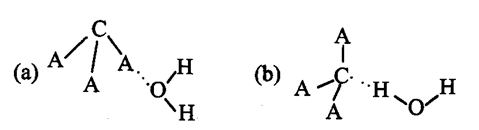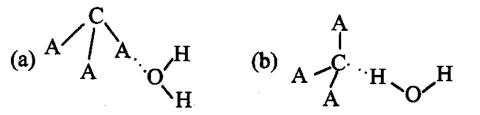- 不同晶体的结构微粒及微粒间作用力的区别
- 共13题
13.下表中操作.现象.结论对应关系正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素,X+既无电子也无中子,Z原子的最外层电子数与最内层相等,Y、Z的最高正价之和与Q的最高正价相等,W的最高正价与最低负价代数和为0。X的单质与Q的单质混合强光照时可发生爆炸。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.在100℃时,将0.40 mol 的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为_______个。
(2)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为_______。

(3)H+可与H2O形成H3O+,H3O+原子采用_______杂化。H3O+中H-O-H键角比H2O中H-O-H键角大,原因为_______。
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为a g·cm-3, NA表示阿伏伽德罗常数,则CaO晶胞体积为_______cm3
正确答案
(1) 2
(2)O—H键、氢键、范德华力;

(3)sp3;H2O中O原子有两对孤对电子,H3O+中O原子只有一对故对电子,排斥力较小
(4)
解析
(1)氧元素的基态核外电子排布式为:1s22s22p4,4个电子在三个轨道中排布,故未成对的电子个数是两个。
(2)化学键是强烈的相互作用;氢键的作用力比化学键弱,但比范德华力的作用力要强。

(3) H3O+的空间构型为三角锥型,故O原子的杂化方式为sp3;H3O+中O原子只有一对故对电子,排斥力较小,使得键角变大。
(4)根据NaCl的晶胞可知,一个晶胞含有4个CaO,设晶胞的体积为V,则:

知识点
36.请从36~38题中任选一题作答。
36.[化学—选修化学与技术]
通常情况下,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,各国都在限制CO2的排量,同时也加强对CO2创新利用的研究。
(1)目前,推广用超临界CO2(介于气态和液态之问)代替氟利昂作致冷剂,这一做法对环境的积极意义是( )。
(2)科学家为提取空气中的CO2,把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应使之变为可再生燃料甲醇。流程如下:
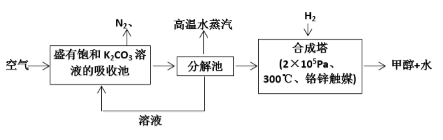
①分解池中反应的化学方程式为:( )。
②合成塔中,若有4.4g
⑶某同学拟用沉淀法测定空气中
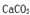
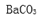
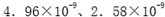
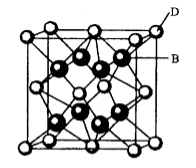
37.[化学一一选修物质结构与性质]有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如右图所示。请回答下列问题。
(1)E元素原子基态时的电子排布式为( );
(2)
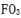
(3)CA3极易溶于水,其原因主要是( ),试判断
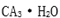
(4)从图中可以看出,D跟B形成的离子化合物的化学式为( );该离子化合物晶体的密度为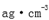
38.[化学——选修有机化学基础]
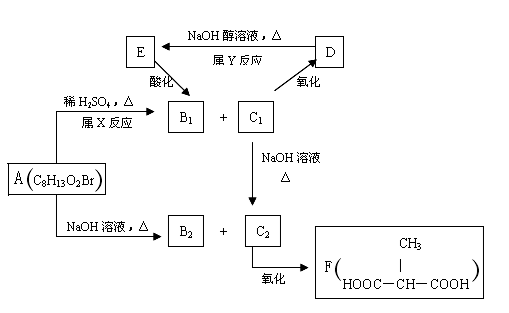
某化合物A在一定条件下能发生如下图所示的转变:
其中只有B1既能使溴水褪色,又能与
(1)指出反应类型:X( )反应,Y ( )反应。
(2)物质A的结构简式为( )。
(3)写出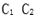
(4)与F互为同分异构体(分子中无环状结构)且核磁共振氢谱只有一种峰的有机物的结构简式有( )。(写一种)
(5)与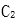
36.请从36~38题中任选一题作答
37.[化学一一选修物质结构与性质]有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如右图所示。请回答下列问题。
(1)E元素原子基态时的电子排布式为 ;
(2)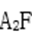
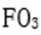
(3)CA3极易溶于水,其原因主要是 ,试判断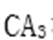

(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合物晶体的密度为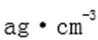
38.[化学——选修有机化学基础]某化合物A在一定条件下能发生如下图所示的转变:
其中只有B1既能使溴水褪色,又能与
(1)指出反应类型:X 反应,Y 反应。
(2)物质A的结构简式为 。
(3)写出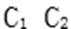
(4)与F互为同分异构体(分子中无环状结构)且核磁共振氢谱只有一种峰的有机物的结构简式有 。(写一种)
(5)与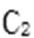
正确答案
36.[化学—选修化学与技术]通常情况下,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,各国都在限制CO2的排量,同时也加强对CO2创新利用的研究。
(1)目前,推广用超临界CO2(介于气态和液态之问)代替氟利昂作致冷剂,这一做法对环境的积极意义是___________________。
(2)科学家为提取空气中的CO2,把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应使之变为可再生燃料甲醇。流程如下:
①分解池中反应的化学方程式为:_____________________________。
②合成塔中,若有4.4g 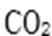
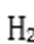
⑶某同学拟用沉淀法测定空气中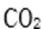

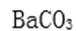

正确答案
正确答案
扫码查看完整答案与解析