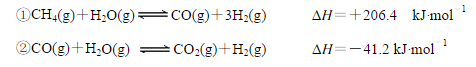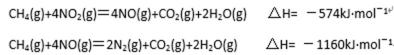- 工业合成氨
- 共12题
(一)污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是
A.氨水
B.硫化氢气体
C.硫酸钠溶液
D.纯碱溶液
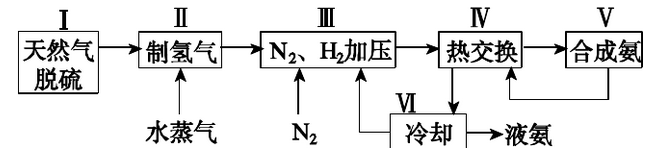
(二)合成氨的流程示意图如下:

(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 ,
;
(2)设备A中含有电加热器、触煤和热交换器,设备A的名称 ,其中发生的化学反应方程式为 ;
(3)设备B的名称 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。不宜从相反方向通水的原因
;
(4) 设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:
正确答案
解析
(一)加入氨水后,Cu2+会生成络合物,不能生成沉淀,故A错;硫酸钠与Cu2+也不会生成沉淀,故C错。H2S与三种离子会生成CuS、HgS和PbS沉淀;纯碱能增大溶液的pH,使三种离子都生成沉淀。
(二)(1)利用空气中氮气的沸点比氧气的沸点低,先将空气加压降温变成液态,然后再加热,使氮气首先从液态空气中蒸发出来,留下的就是液态氧气。故分离方法是液化和分馏。另一种方法是将空气与C反应后除去CO2。采用煤和天然气制备H2的方程式为:C+H2O

(2)合成氨的设备为合成塔;发生的反应是N2+3H2
(3)冷凝分离氨气的设备为冷却塔;为了增强冷却效果,冷却水应从下端进入,逆向冷却效果好。(4)设备c是分离器,能将液氨和未反应的原料分离。
(5)设CO、H2O的起始浓度分别为x、y,且CO的转化率为90%,则:
CO2(g)+H2(g)
起始浓度(mol·L-1) x y 0 0
转化浓度(mol·L-1) 0.9x 0.9x 0.9x 0.9x
平衡浓度(mol·L-1) 0.1x y-0.9x 0.9x 0.9x
K=
知识点
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)
一种工业合成氨的简易流程图如下:
(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: 。
(2)步骤II中制氯气原理如下:
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 。
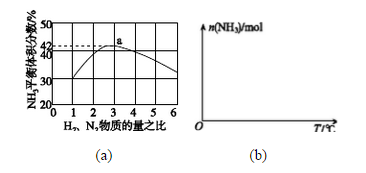
(3)图1表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数: 。
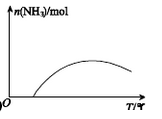
(4)依据温度对合成氨反应的影响,在图2坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,简述本流程中提高合成氨原料总转化率的方法: 。
正确答案
(1)
(2)a 90%
(3)14.5%
(4)
(5)Ⅳ
对原料气加压:分离液氨后,未反应的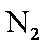

解析
略
知识点
工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)
c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g)
(3)氨气在纯氧中燃烧生成一种单质和水,科学家利用此原理,设计成“氨气-氧气”燃料电池,则通入氨气的电极是__________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为_______________________。
(4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
则甲烷直接将NO2还原为N2的热化学方程式 为 。
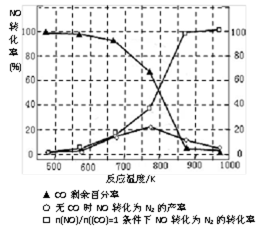
(5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如右图。据图分析,若不使用CO,温度超过775K发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在_______左右。
正确答案
(1)(2分)1 (2)(2分)<(写成“小于”扣1分)
(3)(4分)负极 (2分) 2NH3 — 6e- + 6OH- = N2 +6H2O (2分。化学式1分、配平1分)
(4)(3分)CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g) △H=-867kJ/mol (方程式2分,
△H数值1分)
(5)(5分)该反应是放热反应(1分),当在775K反应达到平衡后继续升高温度(1分),平衡向逆(左)方向移动,NO转化率降低(1分) 870K(2分。写860-875K之间任意数值均给分)
解析
略
知识点
传统合成氨工业需要采用高温、高压和催化剂。近来美国化学家使用新型铁系催化剂,在常温下合成了氨气。下列说法正确的是 ( )
正确答案
解析
略
知识点
合成氨工业对国民经济和社会发展具有重要意义,下图是工业合成氨的简要流程示意图。
(1)合成氨的原料气往往混有CO2等杂质,在进入合成塔之前需净化,其原因是_______。
(2)工业上合成氨选择的适宜条件是:以铁为主的催化剂、_______、_______。
(3)沿X路线进入合成塔的物质是_______,这样设计的意义是_______。
(4)目前工业制硝酸所采用的主要方法是_______法。
正确答案
(1)防止杂质使合成氨所用的催化剂“中毒”
(2)400~500℃;10~30Mpa
(3)N2 和H2;未反应的氮气和氢气循环进入合成塔,使氮气和氢气得到充分利用
(4)氨催化氧化法(或氨氧化法)
解析
略。
知识点
扫码查看完整答案与解析