- 物质的量的相关计算
- 共168题
NA代表阿伏伽德罗常数。已知C2H4和C3H6的混合物的质量为ag,则该混合物
正确答案
解析
略
知识点

正确答案
解析
一个H2O分子中含有10个质子,故18gH2O中含有的质子数为10NA,故A正确;金刚石的结构为正四面体构型,每个碳原子可以和另外的4个碳原子形成共价键,属于每个碳原子的共价键为2个,故12g金刚石中含有的共价键数应为2 NA,故B错误;46gNO2和N2O4混合气体中,不管46gNO2 、还是46gN2O4是所含的物质的量分别是1mol、0.5mol,则其含有的原子总数都为3 NA,故C正确;1molNa与足量的O2反应,钠必然消耗完全,其转移的电子的物质的量必为NA个电子,故D正确。
知识点
某含铬(r2O2-7)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrx·O3。不考虑处理过程中的实际损耗,下列叙述错误的是
正确答案
解析
依据铬、铁元素反应前后的价态以及化合物的化学式中正负化合价的代数和为0的原则,易知FeO·FeyCrxO3中的x、y的值相等且等于1,故D项错误;A、B、C项正确
知识点
25°C和101kpa时,乙烷、乙炔和丙烯组成的混合烃32 mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了72 mL,原混合烃中乙炔的体积分数为
正确答案
解析
由燃烧方程式不难发现,C2H6和C3H6反应后体积缩小的量是相同的,故可将两者看成是一种物质即可。设C2H6和C3H6一共为x mL,C2H2为y mL。则有 x +y = 32;2.5x+1.5y = 72,解得y=8。混合烃中乙炔的体积分数为
知识点
(1)磷、硫元素的单质和化合物应用广泛。
1)磷元素的原子结构示意图是____________。
2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10 10C+P4O10=P4+10CO
每生成1 mol P4时,就有________mol电子发生转移。
3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2=C6H6O6+2H++2I- 2S2O32-+I2=S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1 Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是__________mol。
4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+=I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
该实验的目的是_____________;表中V2=___________mL。
(2)、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是______________。
6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
____Ce3++____H2O2+____H2O =____Ce(OH)4↓+____ _______
正确答案
见解析。
解析
1)写出P原子的结构示意图:
2)每生成1 mol P4时,P由+5价变成0价,电子转移为5×4=20或C化合价由0价变成为+2价,电子转移为2×10=20;
3)n(Na2S2O3)=bV1/1000 mol;与其反应的I2为bV1/2000 mol,与维生素C反应的I2为 
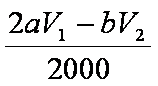
4)由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系。
5)题目中给出:“加热条件下CeCl3易发生水解”,可知NH4Cl的作用是肯定是抑制水解的,CeCl3水解会生成HCl,可以完整答出:NH4Cl的作用是分解出HCl气体,抑制CeCl3水解。
6)根据题意:“强酸性”或观察方程式可知缺项是H+,利用电子得失守恒或观察法就可以配平方程式。2Ce3++H2O2+6H2O= 2Ce(OH)4↓+6H+
知识点
扫码查看完整答案与解析