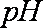- 电解质溶液
- 共721题
7.下列说法正确的是( )
正确答案
知识点
13.下列说法中正确的是
正确答案
解析
A.常温下,pH均等于4的硫酸溶液与醋酸溶液,根据电荷守恒,c(SO42-)与c(CH3COO-)之比为1:2,A正确;B.常温下,向pH=4.0的醋酸溶液中加水稀释后,溶液中c(H+)和c(OH-)的乘积是定值,不可能都变小,B错误;C.常温下,0.1mol/L NaHA溶液的PH=5,溶液中HA-电离大于水解,c(A2-)>c(H2A),C错误;D.0.1mol·L-1的(NH4)2Fe(SO4)2溶液中,NH4+水解,c(NH4+)不等于c(SO42-),D错误;
故选A。
考查方向
解题思路
A.根据电荷守恒,c(SO42-)与c(CH3COO-)之比为1:2;B.常温下,溶液中c(H+)和c(OH-)的乘积是定值;C.常温下,0.1mol/L NaHA溶液的PH=5,溶液中HA-电离大于水解,c(A2-)>c(H2A);D.0.1mol·L-1的(NH4)2Fe(SO4)2溶液中,NH4+水解,c(NH4+)不等于c(SO42-);
易错点
常温下,溶液中c(H+)和c(OH-)的乘积是定值。
知识点
14.下列关于离子浓度的说法正确的是
正确答案
解析
A.加水稀释促进一水合氨电离,铵根离子个数增大,一水合氨分子个数减小,所以溶液中
B. 把握正负离子相等的关系PH=5.6可以得出c(H+)和c(OH-)的关系,而c(Na+)+c(H+)=c(CH3COO-)+c(OH-),不过得出结论是c(Na+)<c(CH3COO -)
C. 在微粒浓度比较错误.溶液中微粒浓度存在正确关系如下:c(B-)>c(Na+)>c(H+)>c(OH-)
D. 含有同等浓度的铵根离子的盐中,化学式中含有铵根离子个数越多其浓度越小,硫酸氢铵电离出氢离子抑制铵根离子水解,所以c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c[(NH4)2SO4]<c(NH4HSO4)<c(NH4Cl),故D错误;
考查方向
本题主要考查了离子浓度大小的比较;盐类水解的应用。
解题思路
本题考查了离子浓度大小的判断,明确电解质的性质是解本题关键,结合质子守恒、电荷守恒来分析解答,难度中等.
易错点
1、加水稀释促进一水合氨电离,铵根离子个数增大
2、溶液中微粒浓度存在正确关系
知识点
10.在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+3B2(g)
下列说法正确的是( )
正确答案
考查方向
解题思路
A.丙为AB3的分解是气体体积增大的反应,所以丙恒温恒压,体积变大,甲恒温恒容,体积不变,所以,V甲<V丙;
B.合成AB3是放热反应,其逆反应AB3分解就是吸热的,乙绝热容器,丙恒温,所以乙反应后比丙温度低,向吸热方向进行的程度小,平衡时乙中AB3浓度比丙高,A2和B2浓度比丙低,K乙>K丙;
C.条件相同时,甲与乙是等效平衡.甲与乙容器体积相同,乙分解AB3吸热导致乙比甲温度低,平衡向合成AB3方向移动,平衡时AB3浓度乙大于甲;
D.甲与丙起始温度和起始体积相同,恒温条件下反应,丙在恒压条件下分解AB3生成B2和A2,平衡时体积比反应前大,即平衡时丙体积大于甲,则压强甲大于丙,所以υ甲>υ丙。
易错点
本题主要考查学生对表格数据的分析利用能力和利用勒夏特列原理分析平衡移动的思维,题目有一定难度。
知识点
11.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
正确答案
解析
A.酸性条件下,NO3-氧化Fe2+,不能大量共存;
B.c(OH-)=10-2mol·L-1,呈碱性,能大量共存;
C.酸性条件,Ag(NH3)2+和Cl-、SO42-反应生成沉淀,不能大量共存;
D.ClO-能氧化SO32-、S2-,不能大量共存。
考查方向
解题思路
酸性条件下,NO3-氧化Fe2+;c(OH-)=10-2mol·L-1,呈碱性;酸性条件,Ag(NH3)2+和Cl-、SO42-反应生成沉淀;ClO-能氧化SO32-、S2-。
易错点
ClO-能氧化SO32-、S2-。
知识点
下列离子在稳定人体血液的pH中起作用的是
正确答案
解析
人体血液不会因为进入少量酸性和碱性的物质而使其pH值超出7.35~7.45之间,原因是血液中含有缓冲物质,如H2CO3/NaHCO3、NaH2PO4/Na2HPO4等,所以对人体血液pH起稳定作用的离子为HCO3-。
知识点
一定温度下,满足下列条件的溶液一定呈酸性的是
正确答案
解析
略
知识点
水是最宝贵的资源之一。下列表述正确的是
正确答案
解析
略
知识点
12.类推的思维方法是化学学习和研究中常用的重要思维方法,但所得结论要经过实践的检验才能确定其正确与否。根据你所掌握的知识,判断下列类推结论中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11. 下列有关实验的叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析