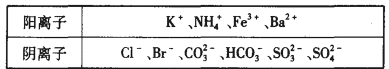- 电解质溶液
- 共721题
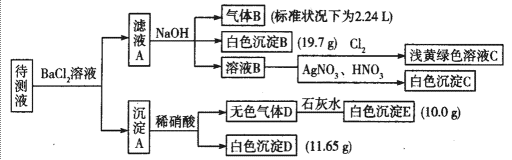
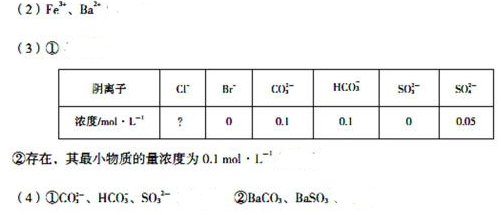
20.1 000 mL某待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
现进行如下实验操作(每次实验所加试剂均过量):
(1)写出生成白色沉淀B的离子方程式:_______________________________。
(2)待测液中肯定不存在的阳离子是_________________。
(3)若无色气体D是单一气体:
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:_______________________________________。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是_____________________.
②沉淀A中能与稀硝酸反应的成分是__________________________(写化学式)。
正确答案
(1)HCO3_ +OH- + Ba2+ = BaCO3+H2O
解析
解析已在路上飞奔,马上就到!
知识点
10.某混合物的水溶液,可能含有以下离子中的若干种K+、NH4+、Al3+、Ba2+、CO32-、SO42-、Cl-、Br-。现分别取100 mL的三等份溶液进行如下实验
①第一份加过量浓NaOH溶液加热后,收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。再向甲溶液中通人过量的CO2,生成白色沉淀,沉淀经过滤.洗涤.干燥.灼烧后,得到1.02 g固体。
②第二份加足量盐酸酸化的BaC12溶液,经过滤.洗涤.干燥后,得到沉淀的质量为11.65 g,
③第三份加CCl4,滴加少量氯水,振荡后静置, CCl4层未变红色;
依据实验回答下列问题
(1)分析上述实验,写出每一实验可以确定离子一定存在或不存在的种类。
实验①可以确定一定存在的离子有___________,一定不存在的离子有_______;
实验②可以确定一定存在的离子有_____________,一定不存在的离子有________;
实验③可以确定一定不存在的离子有_______________________。
(2)试通过分析与计算,原溶液中K+的物质的量浓度为___________mol·L-1。
正确答案
(1) NH4+、Al3+; CO32- ; SO42- ; Ba2+ ; Br-
(2)≥ 0.2
解析
解析已在路上飞奔,马上就到!
知识点
10.下列化学实验事实及其解释都正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
某钠盐溶液中可能含有
①用pH计测得溶液pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中公含
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
正确答案
解析
本题是离子组合推断、离子鉴别实验综合题。题型难点是:熟悉各种离子的标准检验方法,明确各种离子检验时的干扰因素。本题的难点还有:采用的出题方式和平时不同。
根据最终的离子分析:NO2-,存在时一定没有SO32-,I-。因NO2-,的氧化性可以使他们氧化。Cl-存在下的NO2-的检验:加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体。即证明了NO2-的存在又检验出Cl-的存在。但,仅加入盐酸产生刺激性气体也可能有SO32-的存在。故须先确认SO32-不存在。SO32-,CO32-,SO42-的组合检验可以用:加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色。来确认SO32-, SO42-不存在,CO32-一定存在。故选择③④就可以,顺序是先④后③。
知识点
某无色溶液中若含有大量Na2SO4、Na2CO3、NaOH,为验证其中所含的阴离子,若限定只取一次待测液,加入试剂顺序正确的是
正确答案
解析
略
知识点
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
(1)B中反应的离子方程式是______。
(2)A中溶液变红的原因是______。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_______。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为 
①甲同学认为SCN—中碳元素没有被氧化,理由是______。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是______。
③通过实验证明了SCN—中氮元素转化为,他的实验方案是______。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是______mol。
正确答案
见解析。
解析
(1)Cl2+2OH— === Cl—+ClO—+ H2O
(2)Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN—反应生成红色的,所以溶液变红
(3)①Fe3+
(4)①SCN—中的碳元素是最高价态+4价
②硫元素
③取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN—中氮元素被氧化成
④16
知识点
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
(1) 将菱锌矿研磨成粉的目的是_____。
(2) 完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Go
(4)根据下表数据,调节“滤液
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a,大理石粉 b,石灰乳 c,纯碱溶液 d,烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
正确答案
(1)增大反应物接触面积或增大反应速率或使反应更充分
(2)
(3)
(4)
(5)b或(b和d);d
(6)蒸发浓缩、冷却结晶
(7)
解析
(1)将菱锌矿研磨成粉可以增加反应时的接触面积,使反应更加充分。
(2)漂白粉的成分中含有次氯酸根,调节酸碱度后,具有较强的氧化性,能使+2价的铁氧化成+3价,氢氧化亚铁变成氢氧化铁必须增加氢氧元素的量,可以推测出另一种反应物为水,清楚了反应物,一般可以顺利地配平。
(3)化学式量为89,组成元素是



(4)






(5)a大理石粉难溶于水、选择熟石灰和烧碱溶液可以使溶液的碱性增强,有利于镁离子完全沉淀。
(6)蒸发浓缩、冷却结晶能使晶体尽快地析出。
(7)综合计算(不展开)
知识点
水溶液X中只可能溶有K+.Mg2+.Al3+.



某同学对该溶有进行了如下实验:
下列判断正确的是
正确答案
解析
溶液X加过量稀盐酸有气体甲生成,该气体可能是CO2.SO2或混合物,故选项A错误;溶液中应该含有



知识点
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
正确答案
解析
与BaCl2溶液反应生成的白色沉淀可能是SO42-或CO32-或SO32-,故A错;在四氯化碳中显紫色的是I2,故B正确;黄色火焰可以覆盖K+的浅紫色火焰,故火焰呈黄色,也可能有K+,故C错;因NH3极易溶于水,若溶液中含有少量的NH4+时,滴加稀NaOH溶液不会放出NH3,故D错。
知识点
11.最近一段时间雾霾严重,影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH、Mg2+、Al3+、SO、NO、Cl-。高三班同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下实验:
已知:3NO+8Al+5OH-+2H2O
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
正确答案
解析
加强碱后产生的气体1能使湿润的红色石蕊试纸显蓝色——NH3,——雾霾中有NH4+;加强碱后产生的沉淀1遇H+部分溶解——沉淀1中必有硫酸钡和氢氧化镁——雾霾中有硫酸根和镁离子;根据已知信息和气体2的性质知道溶液2中一定有NO3-;滤液1中一定有过量的氢氧化钡,通入CO2后会生成碳酸钡沉淀;如果试样中有Al3+,到滤液1中变成AlO2-,通入CO2后会生成氢氧化铝沉淀,遇到H+也会全部溶解,不影响碳酸钡沉淀生成CO2气体。故试样中可以有Al3+,所以A对;C错;B项中Na+,Cl-不影响检验流程中的任何现象,故可能存在,对。D项只是将可能存在的离子组合成了可能的物质,没有引入新粒子,对。
故本题选择C.
考查方向
解题思路
加强碱后产生的气体1能使湿润的红色石蕊试纸显蓝色——NH3,雾霾中有NH4+;加强碱后产生的沉淀1遇H+部分溶解——沉淀1中必有硫酸钡和氢氧化镁——雾霾中有硫酸根和镁离子;根据已知信息和气体2的性质知道溶液2中一定有NO3-;滤液1中一定有过量的氢氧化钡,通入CO2后会生成碳酸钡沉淀;如果试样中有Al3+,到滤液1中变成AlO2-,通入CO2后会生成氢氧化铝沉淀,遇到H+也会全部溶解,不影响碳酸钡沉淀生成CO2气体。故试样中可以有Al3+; Na+,Cl-不影响检验流程中的任何现象,故可能存在;D项只是将可能存在的离子组合成了可能的物质,没有引入新粒。
易错点
不能通过实验现象得出是否含有相应离子
知识点
扫码查看完整答案与解析