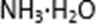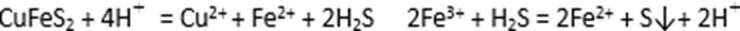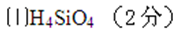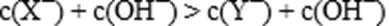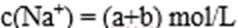- 电解质溶液
- 共721题
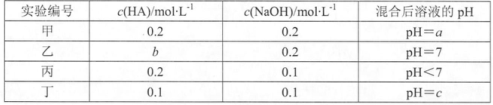
11.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
下列对混合后溶液的有关说法中,不正确的是()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.关于各组溶液中微粒浓度的关系正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
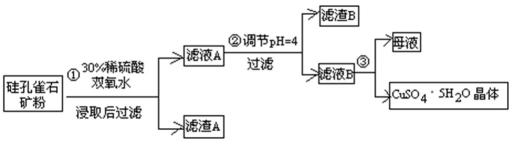
28.硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜。
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为
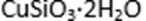
请回答下列问题:
(1)完成步骤①中稀硫酸与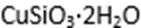
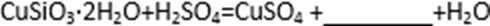
(2)步骤②调节溶液pH选用的最佳试剂是( )
A. CuO B. MgO C. FeCO3 D.
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
由上表可知:当溶液pH=4时,不能完全除去的离子是( )。
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到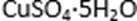
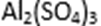
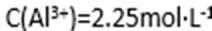
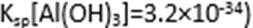
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
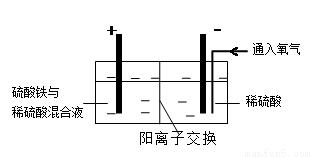
Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+ Cu2+(水相)
Ⅳ.电解硫酸铜溶液制得金属铜。
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是( )(用电极反应式表示)。
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是( ) 。
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.向NaOH(aq)滴入HCOOH(aq)的过程中,所得到的混合溶液中离子浓度的大小关系可能正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12. 下列比较中,正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。现将

①若HA为HCN,该溶液显碱性,则溶液中c(CN—)( )c(Na+)(填“<”、“=”或“>”),你得出该结论的依据是( )。
②若HA为CH3COOH,该溶液显酸性。溶液中所有的离子按浓度由大到小排列的顺序是( )
(2)二氧化氯(ClO2)为一种黄绿色气体,
①图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:( )。
②电解一段时间,当阴极产生的气体体积为336 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为( )mol;用平衡移动原理解释阴极区pH增大的原因( )。
(3)25℃时,



正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.现有a mol/L NaX和b mol/L NaY两种盐溶液。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.25 ℃时,浓度为0.1 mol/L的HA溶液和BOH溶液,pH分别是1和11。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.常温下,用0.1000 mol/L HCl溶液滴定20.00 mL 0.1000 mol/L NH3•H2O溶液,滴定曲线如下图。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析