- 复杂化学式的确定
- 共54题
7.下列电解质溶液有关叙述正确的是
正确答案
解析
Ka是温度的函数,与浓度的大小无关,A错误。向Mg(OH)2沉淀悬浊液中加入NH4Cl固体,溶解产生的OH-与NH4+结合,促进了Mg(OH)2的溶解,c(Mg2+)增大、c(OH-)减小,B错误。
在NaHCO3中存在:NaHCO3=Na++HCO3-与HCO3-+H2O




考查方向
解题思路
盐的水解抓大放小,弄清那一步是起决定作用。
易错点
离子浓度大小判断
知识点
22.在100g浓度为ω%的稀硫酸中加入4g氧化铜粉末,待氧化铜全部溶解后,向所得蓝色溶
正确答案
解析
所得滤渣中铜元素的质量与氧化铜中铜元素的质量相等,则铜的质量为:
设生成3.2g铜需要铁的质量为x,生成硫酸亚铁的质量为y
Fe+CuSO4=FeSO4+Cu
56 64
x 3.2g
解得x=2.8g
而剩余的滤渣中含铁的质量是1.6g,故与硫酸反应的铁的质量为:10g-2.8g-1.6g=5.6g
设生成的氢气的质量为y
Fe+H2SO4=FeSO4+H2↑
56 2
5.6g z
解得z=0.2g
反应硫酸全部转化生成硫酸亚铁,根据铁、硫酸和硫酸亚铁的质量关系,设消耗的硫酸的质量为a,生成的硫酸亚铁的质量为b
Fe~H2SO4~FeSO4
56 98 152
8.4g a b
解得a=14.7,b≈22.8g
A、根据计算可知,4.8g滤渣是由3.2g铜和1.6g铁组成,故A正确;
B、硫酸溶液的质量分数为:
C、状况不知,无法求体积,故C错误;
D、硫酸亚铁溶液的质量分数为:
考查方向
化学计算
解题思路
根据已有的知识进行分析,在化学反应前后,铜元素的质量不变,氧化铜能与硫酸反应生成硫酸铜和水,而铁能与硫酸铜反应生成硫酸亚铁和铜,据此解答即可
易错点
计算结果的准确性
教师点评
本题考查了根据化学方程式的计算,完成此题,可以依据题干提供的信息结合质量守恒定律进行
知识点
17.向300mlKOH溶液中缓慢通入2.24L(标准状况下)CO2气体,CO2完全反应后,再小心减压蒸干溶液,得到11.9g白色固体。则下列说法中正确的是
正确答案
解析
2.24L(标况下)CO2气体的物质的量为0.1mol,
若只发生:CO2+2KOH=K2CO3+H2O,则生成0.1mol的K2CO3,其质量=0.1mol×138g/mol=13.8g,
若只发生:CO2+KOH=KHCO3,则生成0.1mol的KHCO3,其质量=0.1mol×100g/mol=10g,
由于13.8g>11.9g>10.0g,所以得到的白色固体是K2CO3和KHCO3的混合物;
设白色固体中K2CO3 的物质的量为x ,KHCO3 的物质的量为y ,
根据碳原子守恒,有:x +y =0.1 mol,
由二者质量可知:138g•mol-1x+100 g•mol-1y =11.9g
联立方程,解得x=0.05mol y=0.05mol
故白色固体中含有K2CO3 的质量=138g•mol-1×0.05 mol=6.9g,
原溶液中KOH物质的量为 2x+y=2×0.05mol+0.05mol=0.15mol,所用KOH溶液物质的量浓度为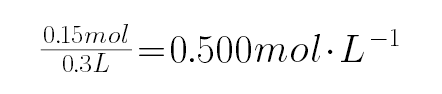
A、二氧化碳通入溶液后,首先生成K2CO3,故A错误;
B、由于13.8g>11.9g>10.0g,所以得到的白色固体是K2CO3和KHCO3的混合物,故B错误;
C、由上分析可知,原KOH溶液中物质的量浓度一定是0.500mol/L,故C正确;
D、所以得到的白色固体是K2CO3和KHCO3的混合物,故D错误;
考查方向
化学方程式的有关计算
解题思路
2.24L(标况下)CO2气体的物质的量为0.1mol,二氧化碳完全反应,若只发生:CO2+2KOH=K2CO3+H2O,则生成0.1mol的K2CO3,其质量=0.1mol×138g/mol=13.8g;
若只发生:CO2+KOH=KHCO3,则生成0.1mol的KHCO3,其质量=0.1mol×100g/mol=10g,由于13.8g>11.9g>10.0g,所以得到的白色固体是K2CO3和KHCO3的混合物,
设白色固体中K2CO3 x mol,KHCO3 y mol,根据C元素守恒及二者质量列方程计算,再根据钾离子守恒计算KOH物质的量,根据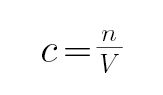
易错点
判断固体物质的成分组成
教师点评
本题考查混合物的计算,题目难度中等,利用极限法判断产物的组成是解题关键
知识点
6.已知高能锂电池的总反应式为:2Li+ FeS =Fe+ Li2S [LiPF6.SO( CH3)2为电解质],用该电池为电源进行如右图的电解实验,电解一段时间测得甲池产生标准状况下H2 4.48 L。下列有关叙述不正确的是()
正确答案
解析
A、由反应FeS+2Li=Fe+Li2S可知,Li被氧化,应为原电池的负极,FeS被还原生成Fe,为正极反应,正极方程式为FeS+2e﹣=Fe+S2﹣,甲连接原电池负极,A为阴极,生成氢气,电极方程式为2H++2e﹣=H2↑,n(H2)==0.2mol,转移0.4mol电子,生成0.4molOH﹣,则隔膜H中通过的K+离子数为0.4mol,通过的离子数目为0.4NA,故A正确;
B、甲连接原电池负极,为阴极,生成氢气,电极方程式为2H++2e﹣=H2↑,n(H2)=0.2mol,转移0.4mol电子,生成0.4molOH﹣,则隔膜H中通过的K+离子数为0.4mol,c(OH﹣)==4mol/L,即电解后甲池中溶液浓度为4mol/L,故B正确;
C、A电极为阴极,故C错误;
D、FeS被还原生成Fe,为正极反应,正极方程式为FeS+2e﹣=Fe+S2﹣,故D正确。
故选C
考查方向
解题思路
由反应FeS+2Li=Fe+Li2S可知,Li被氧化,应为原电池的负极,FeS被还原生成Fe,为正极反应;甲连接原电池负极,A为阴极,生成氢气,电极方程式为2H++2e﹣=H2↑,结合电极方程式计算.
易错点
电极反应书写
知识点
扫码查看完整答案与解析



