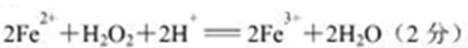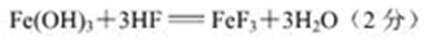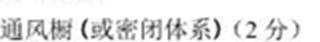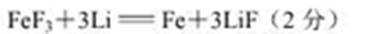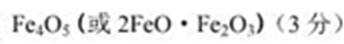- 复杂化学式的确定
- 共54题
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式。
该氢化物受撞击则完全分解为氮气和氢气。4.30g该氢化物受撞击后产生的气体在标准状况下的体积为_______L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0kg水,计算推进剂中联氨的质量。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为
6NO+ 4NH3=5N2+6H2O
6NO2+ 8NH3=7N2+12H2O
NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156mol氮气,吸收后氨水密度为0.980 g/cm3。
计算:①该混合气体中NO与NO2的体积比。②吸收后氨水的物质的量浓度(答案保留1位小数)。
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80mol NH3,生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比。
正确答案
(1)HN3 ;4.48
(2)64kg
(3)9:1;2.4molL
(4)3:1:1
解析
本题主要考察与化学有关的计算。
(1)一分子该氢化物中分子中含氮原子个数
(2)根据题意书写出方程式为2HN3=3H2+N2,则1mol该氢化物受撞击后产生的气体为2mol,4.30g氢化物的物质的量为0.1mol,产生0.2mol气体,标况下为4.48L。
(3)由联氨和四氧化二氮完全反应写出方程式为2N2H4 +N2O4=3N2+4H2O,生成72.0kg水需要联氨64kg。
①设NO与NO2的物质的量分别为x、y,则根据方程式:

联立方程组解得x=162mol y=18mol
根据阿伏伽德罗定律,二者体积比为162mol:18mol=9:1
②氨水中溶质的总物质的量为
根据反应方程式,消耗的氨气物质的量为
则吸收后的溶液中氨水的物质的量为157.058-132=25.058mol
吸收后的溶液中氨水的体积为
氨水物质的量浓度为25.058mol/10.43L=2.4molL
(4)由提示可得,生成链状二聚物、三聚物的方程式可简写为
2CO(NH2)2→二聚物+NH3 ……………………………①
3CO(NH2)2→三聚物+2NH3 ……………………………②
可以推出参加反应的尿素和生成氨气的物质的量之差为生成聚合物的物质的量
因此生成聚合物的物质的量=120mol-80mol=40mol
根据聚合物中碳原子守恒,可计算聚合物中平均含碳原子个数为120mol/40mol=3,而链状二聚物和三聚物的混合物中平均碳原子数只能小于3,说明除了生成链状二聚物、三聚物外还有环状三聚物,则 CO(NH2)2→环状三聚物+3NH3…………………………③
设生成二聚物、链状三聚物、环状三聚物的物质的量分别为x、y、z,则依据上述三个方程式,列方程组:

x + 2y +3z =80 mol
解得x=30mol y=10mol z=10mol
故三种聚合物的物质的量之比为30:10:10=3:1:1
另解:设最后产物中链状三聚物的物质的量分数为x,环状三聚物的物质的量分数为y,根据参加反应的尿素和生成的氨气比例列方程:

故三种聚合物的物质的量之比为0.6:0.2:0.2=3:1:1
知识点
PbO2是褐色固体,受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1 mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为3:2,则剩余固体的组成及物质的量比是
正确答案
解析
本题通过元素化合物转化考查考生计算、分析推理能力。PbO2受热分解得到氧气和铅的氧化物的混合物(Pb为+4、+2价),铅的氧化物的混合物再与盐酸作用时,+4价Pb还原为+2价,Cl-被氧化为Cl2,此时得到溶液为PbCl2溶液,利用“电荷守恒”知1molPbO2在上述转化过程中共转移2mole-。设该过程得到O2的物质的量为3xmol,则Cl2的物质的量为2xmol,利用电荷守恒可得:3x×4+2x×2=2,解得x=0.125,故知1mol PbO2在受热分解过程中产生0.375molO2,利用原子守恒可知受热后的剩余固体中n(Pb):n(O)=4:5,结合选项可知只有A、D项满足n(Pb):n(O)=4:5,故答案为:AD。
知识点
某种电池的正极材料,可通过下列方法制得:
①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静
置24 h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80'c恒温加热24 ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以1000C预处理6 h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是___(用离子方程式表示)
(2)步骤②的反应瓶材质可能是___(填序号)
A.玻璃 B.陶瓷 C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为____
(4)从安全的角度考虑,在实验室里制三氟化铁时应在____中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反
应的化学方程式为____
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672 mL C12, Fe2+恰好被完全氧化成
Fe3十,然后把溶液蒸干,灼烧至恒重得9.6 g固体,则该铁氧体的化学式为____。
正确答案
(1)
(2)C(2分)
(3)
(4)
(5)
(6)
解析
略
知识点
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
请回答下列问题:
(1)元素Z位于周期表中第__________周期,__________族;
(2)这些元素的氢化物中,水溶液碱性最强的是__________(写化学式);
(3)XW2的电子式为__________;
(4)Y的最高价氧化物的化学式为__________;
(5)W和Y形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为__________。
正确答案
(1)三,VA族;
(2)NH3;
(3)
(4)N2O5;
(5)S4N4
解析
由题干先推导出Z元素为磷元素,则X、Y、W分别是C、N、S。(3)小题的电子式教材中没有,得由二氧化碳的结构类比而来。(5)小题中计算为N(S):N(N)=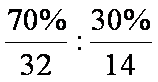
知识点
平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,
得到Ce(OH)4和硫酸铁铵:
已知:
ⅰ,酸性条件下,铈在水溶液中有



ⅱ。CeO2不溶于稀硫酸
ⅲ,硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂C的是 ( )
A,NaClO B,H2O2 C,KMnO4 D,浓硫酸
(2)操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是: 。
(3)反应①之前先要洗涤滤渣B,其目的是为了除去 (填离子符号)。
(4)写出反应①的化学方程式 。
(5)用滴定法测定制得的Ce(OH)4产品纯度。
若滴定时所用定量仪器的最小刻度为 ;所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(6)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。
正确答案
(1)B
(2)冷却结晶 取样于试管中加入NaOH溶液,加热,在试管口置一湿润的红色石蕊试纸
(3)Fe3+ 、Fe2+
(4)2CeO2+ H2O2 + 3H2SO4 → Ce2(SO4)3 + O2↑+ 4H2O
(5),0.1ml;偏大
(6)Fe2(SO4) 3·2(NH4) 2SO4·2H2O
解析
略
知识点
扫码查看完整答案与解析