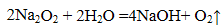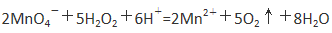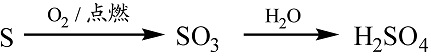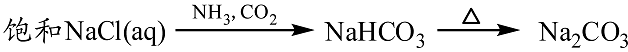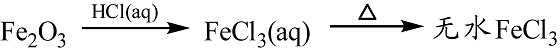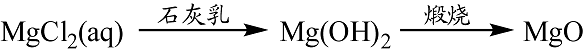- 钠的重要化合物
- 共64题
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
正确答案
解析
略
知识点
水是生命之源,万物之基,是人类最宝贵的自然资源
(1)我国规定水质各种指标的主要要求为:a.不得呈现异色:b.不得有异味:C.水应澄清透明:d,不得含有细菌和病毒。前两项指标可以利用活性炭的____作用来实现:后两项指标可以通过加入消毒剂、絮凝剂反应、沉降,然后通过_____(填操作名称)来实现
(2)我国规定饮用水的硬度不超过25度硬度的表示方法是:将水中的



(3)某地下水的硬度是由Ca(HC03)2所引起的,下列方法中能够使之软化的是_____
正确答案
解析
略
知识点
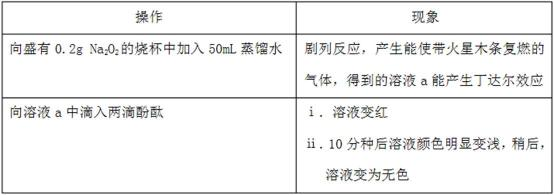
某小组通过实验研究Na2O2与水的反应。
(1)Na2O2与水反应的化学方程式是 。
(2)ⅱ中溶液褪色可能是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应。
Ⅰ.甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂 (填化学式),有气体产生。
Ⅱ.乙同学查阅资料获悉:用KMnO4 (被还原为Mn2+)可以测定H2O2的含量。
取3 mL溶液a稀释至15mL,用稀H2SO4酸化,再逐滴加入0.0045 mol·L-1 KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗10 mL KMnO4溶液。
①KMnO4与H2O2反应的离子方程式是 。
②溶液a中c(H2O2)= mol·L-1。
③溶液褪色速率开始较慢后变快的原因可能是 。
(3)为探究现象ⅱ产生的原因,同学们继续进行了如下实验:
Ⅰ.向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0.1mol·L-1 NaOH溶液,溶液变红又迅速变无色且产生气体,10分钟后溶液变无色,该过程无明显热效应。
Ⅱ.向0.1mol·L-1 NaOH溶液中滴入两滴酚酞的,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入氧气,溶液颜色无明显变化。
② 从实验Ⅰ和Ⅱ中,可得出的结论是 。
②同学们进一步通过实验证实了溶液a中滴入酚酞后,H2O2与酚酞发生了化学反应。实验方案是:取少量溶液a于试管中, 。
正确答案
见解析。
解析
(1)
(2)Ⅰ.
Ⅱ.①
②0.0375
③反应生成的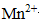
(3)①碱性条件下,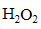
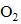
②加入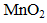
知识点
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法一:
方法二:
方法三:
方法四:不使用化学试剂,使用实验室常用仪器
按要求回答下列问题:
(1)方法一:加入足量的试剂A (填写A的化学式)可将HCO3— 离子转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、 、洗涤和 ;
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要的用到的是 ,在操作2中应选择的指示剂是 ;
(3)在方法二中计算该样品中NaHCO3的质量分数为 [用流程图中的数据m、V(HCl) 填写有关的表达式];
(4)在方法三中:根据所用的实验装置,除了称量试样质量外,还需测定的实验数据是 ;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是 ,偏低的原因可能是 (均文字简述);
正确答案
(1)Ca(OH)2或 Ba(OH)2 (写名称不给分);过滤 、干燥(烘干)
(2)100 mL容量瓶, 甲基橙
(3)
(4)(4)装有碱石灰的干燥管在实验前后的质量
(5)碱石灰可能还会吸收空气中的水蒸气和CO2气体 
解析
略
知识点
某些资料认为:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:
假设Ⅰ. 过氧化钠氧化二氧化氮
假设Ⅱ. 二氧化氮氧化过氧化钠
(1)小组甲同学设计实验如下:
① 试管A中反应的化学方程式是 。
② 待试管B中收集满气体,向试管B中加入适量 Na2O2粉末,塞紧塞子,轻轻振荡
试管内粉末,观察到红棕色气体迅速消失;再将余烬木条迅速伸进试管内,看见木
条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实
验目的,在A、B之间增加一个装置,该装置的作用是 。
③ 乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;
余烬木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的方程式是 。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:① 2NO+Na2O2=2NaNO2
② 6NaNO2+3H2SO4=3Na2 SO4+ 2HNO3+4NO↑+2H2O;
③ 酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。
① B中观察到的主要现象是 ,F装置的作用是 。
② 在反应前,打开弹簧夹,通入一段时间N2,目的是 。
③ 充分反应后,检验D装置中发生反应的实验是 。
正确答案
见解析。
解析
(1)① Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O
② 除去生成NO2气体中混有的水蒸气
③ Na2O2+2NO2=2NaNO3
(2)① 铜片逐渐溶解,溶液变为蓝色,有无色气泡产生
吸收未反应的NO
② 将装置中的空气排出
③ 取D装置中产物少许,加入稀盐酸,若产生无色气体,遇到空气变为红棕色,产物是亚硝酸钠,反之为硝酸钠。
知识点
下列关于化学与生产、生活的认识说法正确的是
正确答案
解析
略
知识点
下列物质转化在给定条件下能实现的是
①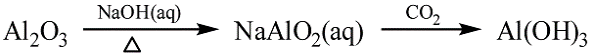
③
④
⑤
正确答案
解析
略
知识点
1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是()
正确答案
解析
略
知识点
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如下:
(1)A的化学式是_______,装置III中A在_______极区产生。
(2)II中反应的离子方程式是_______。
(3)通电电解前,检验III中阴离子的方法和步骤是_______。
(4)为防止II中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,还可以选择的还原剂是_______(填字母编号)。
A.Na2O2
B.FeCl2
C.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07

(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时所得溶液中离子浓度由大到小的顺序是_______。
正确答案
(1)H2SO4;阳
(2)2ClO2+H2O2+2OH-=2ClO
(3)取少量Ⅲ中溶液少许于试管中,先加入足量稀盐酸,无沉淀生成,再加入BaCl2溶
液,产生白色沉淀,证明含有SO42-
(4)a
(5)1.07×1010mol·L-1
(6)c(H+)>c(SO42-)>c(Cu2+)>c(OH-)
解析
略。
知识点
11. 下列因果关系叙述正确的是
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析