- 钠的重要化合物
- 共64题
7.侯氏制碱法中,对母液中析出NH4Cl无帮助的操作是( )
正确答案
解析
母液中析出NH4Cl,则溶液应该达到饱和,饱和NH4Cl溶液中存在溶解平衡:NH4Cl(s)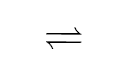
A.通入二氧化碳后,对铵根离子和氯离子没有影响,则对母液中析出NH4Cl无帮助,故A正确;
B.通入氨气后,溶液中铵根离子浓度增大,平衡向着逆向移动,有利于氯化铵的析出,故B错误;
C.冷却母液,氯化铵的溶解度降低,有利于氯化铵的析出,故C错误;
D.加入食盐,溶液中氯离子浓度增大,平衡向着逆向移动,有利于氯化铵的析出,故D错误;
考查方向
沉淀溶解平衡
解题思路
饱和NH4Cl溶液中存在溶解平衡:NH4Cl(s)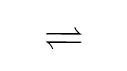
易错点
对于溶解平衡:NH4Cl(s)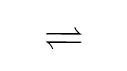
教师点评
本题考查了溶解平衡及其应用,题目难度不大,明确影响溶解平衡的因素为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力
知识点
6.工业生产措施中,能同时提高反应速率和产率的是
正确答案
解析
A.增大压强加快反应速率,且合成氨的反应为体积缩小的反应,则加压平衡正向移动,利用提高产率,故A正确;
B.催化剂对平衡移动无影响,不影响产率,故B错误;
C.二氧化硫的催化氧化反应为放热反应,则升高温度平衡逆向移动,产率降低,故C错误;
D.侯氏制碱法循环利用母液可提高产率,但对反应速率无影响,故D错误
考查方向
化学反应速率、化学平衡
解题思路
A.增大压强加快反应速率,且合成氨的反应为体积缩小的反应;
B.催化剂对平衡移动无影响;
C.二氧化硫的催化氧化反应为放热反应;
D.侯氏制碱法循环利用母液可提高产率,但对反应速率无影响
易错点
D项循环利用母液可提高产率,但对反应速率无影响
教师点评
本题考查化学反应速率及化学平衡的影响因素,把握温度、压强、催化剂对反应的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大
知识点
17.某溶液由Na+、Ag+、Ba2+、Al3+、AlO2-、Fe2+、NO3-、Cl-、SO42-中若干种组成,现将溶液分成两等份,再分别通入足量的NH3和SO2充分反应后,最终均有白色沉淀生成。则溶液中一定含有的离子有
正确答案
解析
分成两等份,再分别通入足量的NH3和SO2充分反应后,最终均有白色沉淀生成,因Ag+与足量氨水反应生成络离子,Al3+与氨水反应生成白色沉淀,Fe2+与氨水反应生成氢氧化亚铁最终转化为红褐色沉淀;
另一份中,NO3-、SO2发生氧化还原反应生成SO42-,SO42-与Ag+或Ba2+结合生成白色沉淀,
综上所述,一定含Al3+、NO3-,Ag+、Ba2+至少含一种,一定不含AlO2-、Fe2+,
不能确定是否含SO42-、Na+、Cl-
考查方向
常见离子的检验
解题思路
分成两等份,再分别通入足量的NH3和SO2充分反应后,最终均有白色沉淀生成,因Ag+与足量氨水反应生成络离子,Al3+与氨水反应生成白色沉淀,Fe2+与氨水反应生成氢氧化亚铁最终转化为红褐色沉淀;
另一份中,NO3-、SO2发生氧化还原反应生成SO42-,SO42-与Ag+或Ba2+结合生成白色沉淀,以此来解答
易错点
SO2的水溶液易被氧化为SO42-
教师点评
本题考查常见离子的检验,把握常见离子之间的反应、白色沉淀的判断为解答的关键,侧重分析与推断能力的综合考查,充分考查了学生灵活应用基础知识的能力,题目难度不大
知识点
1.化学与社会、生活密切相关。对下列现象或事实的解释正确的是
正确答案
解析
A.化铝受热分解生成水,并吸收大量的热,是周围环境温度降低,且生成的氧化铝熔点高,附着在可燃物表面,从而阻止可燃物燃烧,故A错误
B. 二氧化硅是酸性氧化物,常温下能够与氢氟酸反应,故B错误
C. 过氧化钠与二氧化碳反应,生成碳酸钠和氧气,过氧化钠既作氧化剂又做还原剂,故C错误
D. 乙烯是一种植物生长调节剂,对水果蔬菜具有催熟的作用,乙烯含有不饱和键能被高锰酸钾氧化,故D正确。
故本题选D。
考查方向
解题思路
A.氢氧化铝受热分解生成水,并吸收大量的热,是周围环境温度降低
B.二氧化硅是酸性氧化物,常温下能够与氢氟酸反应
C.过氧化钠与二氧化碳反应,生成碳酸钠和氧气,过氧化钠既作氧化剂又做还原剂
D.乙烯是一种植物生长调节剂,对水果蔬菜具有催熟的作用
易错点
过氧化钠用于呼吸面具中作为氧气的来源,反应中过氧化钠既作氧化剂又做还原剂
知识点
扫码查看完整答案与解析

