- 结构式
- 共4题
17.将Fe和Fe2O3的混合物加入25mL 2mol/L的HNO3溶液中,反应完全后,无固体剩余,生成224mL NO气体(标准状况),再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积至少是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
化学在环境保护中趁着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1) 催化反硝化法中,H2能将NO3—还原为N2,25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为 。
②上述反应离子方程式为 ,其平均反应速率v(NO3—)为 mol ∙L—1 ∙min—1
③还原过程中可生成中间产物NO2—,写出3种促进NO2—水解的方法 。
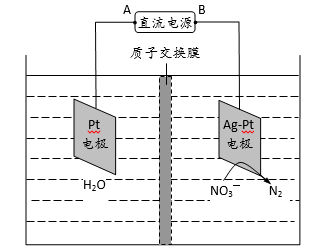
(2)电化学降解NO3—的原理如题图所示。
①电源正极为 (填“A”或“B”),阴极反应式为 。
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
正确答案
(1)①N≡N
②
③加酸,升高温度,加水
(2)①A, 2NO3-+6H2O+10e-=N2+12OH-
②14.4
解析
(1)①N2分子中氮原子间通过氮氮三键结合,因此其结构式为N≡N;②利用溶液pH变化可知有OH-生成,再结合原子守恒可写出反应的离子方程式;利用离子方程式知v(NO3-)=v(OH-)=(10-2-10-7)/10=0.001mol/(L·min);③水解是吸热反应,NO2-水解使溶液中c(OH-)变大,因此可促进NO2-水解的措施有加热、加水或加酸等。
(2)①由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H2O参与反应且有OH-生成;②转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=18g-3.6g=14.4g。
知识点
下列有关化学用语表示正确的是
正确答案
解析
略
知识点
下列有关化学用语表示正确的是
正确答案
解析
有关化学用语常涉及常见物质的组成和结构,尤其是一些常见物质电子式、结构式、结构简式及模型等等,内容比较基础。
知识点
扫码查看完整答案与解析